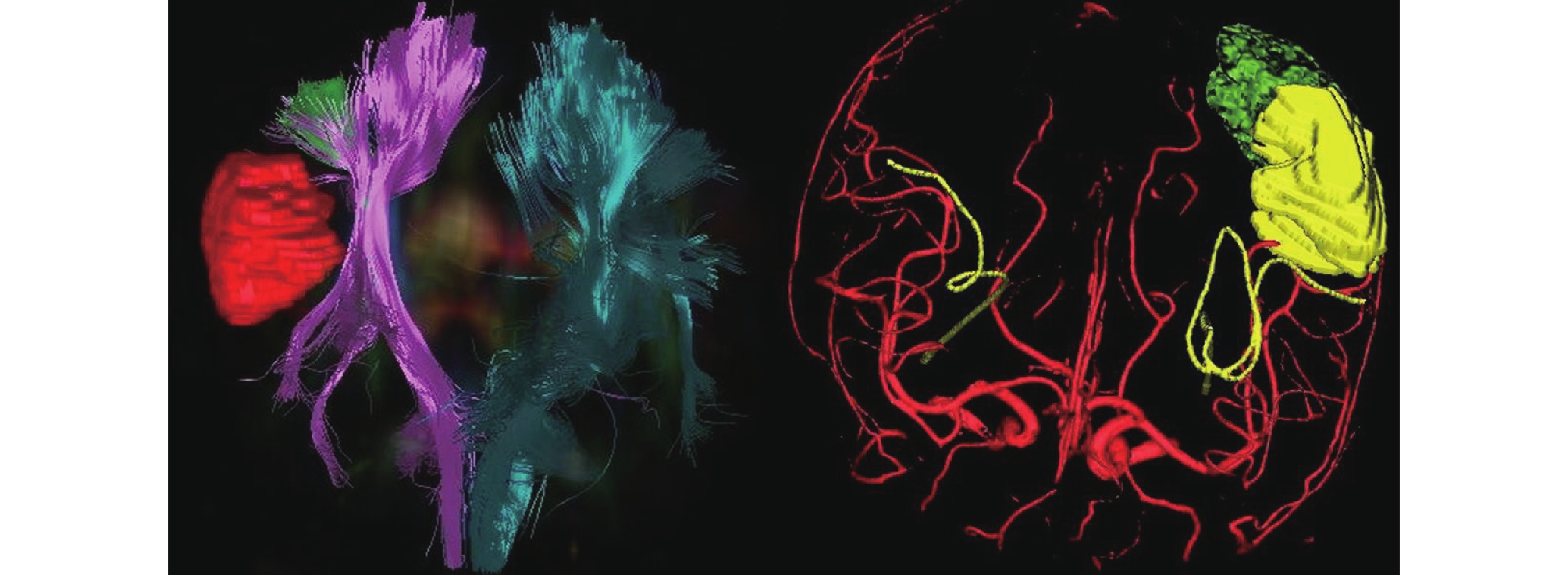引用本文: 郭韜, 郭非, 劉倩薇. 神經導航聯合超聲切除伴發癲癇的腦膠質瘤. 癲癇雜志, 2019, 5(3): 176-181. doi: 10.7507/2096-0247.20190031 復制
腦膠質瘤是最常見的中樞神經系統腫瘤,很多患者因伴發癲癇就診。伴發癲癇的腦膠質瘤首要治療方法是手術切除。但術中常存在腫瘤邊界不清、與重要功能區或致癇灶關系密切難以切除等問題。本研究回顧性分析了 2012 年 6 月 30 日—2014 年 6 月 30 日期間于河北省人民醫院神經外科行手術切除的 47 例伴發癲癇的腦膠質瘤患者臨床資料,對神經導航聯合術中超聲在切除伴發癲癇的腦膠質瘤中的應用價值,并進行總結分析,為相關疾病的外科手術治療提供參考。
1 資料與方法
1.1 一般資料
收集 2012 年 6 月 30 日—2014 年 6 月 30 日在河北省人民醫院神經外科行手術治療的腦膠質瘤伴發癲癇患者 47 例。其中男 31 例,女 16 例;年齡 14~71 歲,平均(53.2±10.6)歲。
1.2 臨床表現
全部患者至少有 1 次癲癇發作史,其中 29 例首發癥狀為癲癇。發作類型:復雜部分性癲癇發作 11 例,簡單部分性發作 17 例,全面性強直陣攣性發作 19 例。26 例伴頭痛、眼底水腫,13 例存在肢體麻木、無力癥狀,4 例有視野缺損。14 例神經系統查體陰性。
1.3 影像學檢查
全部患者均行斷層掃描(CT)、核磁共振(MRI)、彌散張量成像(DTI)、磁共振血管成像(MRA)檢查。腫瘤位于額葉 23 例、顳葉 11 例、枕葉 4 例、頂葉 2 例、多腦葉 7 例。MRI 測量病灶直徑 2.4~11.3 cm,平均(6.7±1.5)cm。
1.4 致癇灶定位
全部患者應用美國 Nicolet 64 導視頻腦電(VEEG)監測系統,按照國際 10/20 系統安置電極,描記清醒、睡眠期腦電圖(EEG),捕捉發作期 EEG 5~7 次,根據發作間期和發作期異常放電,結合發作期臨床表現,定位致癇灶。
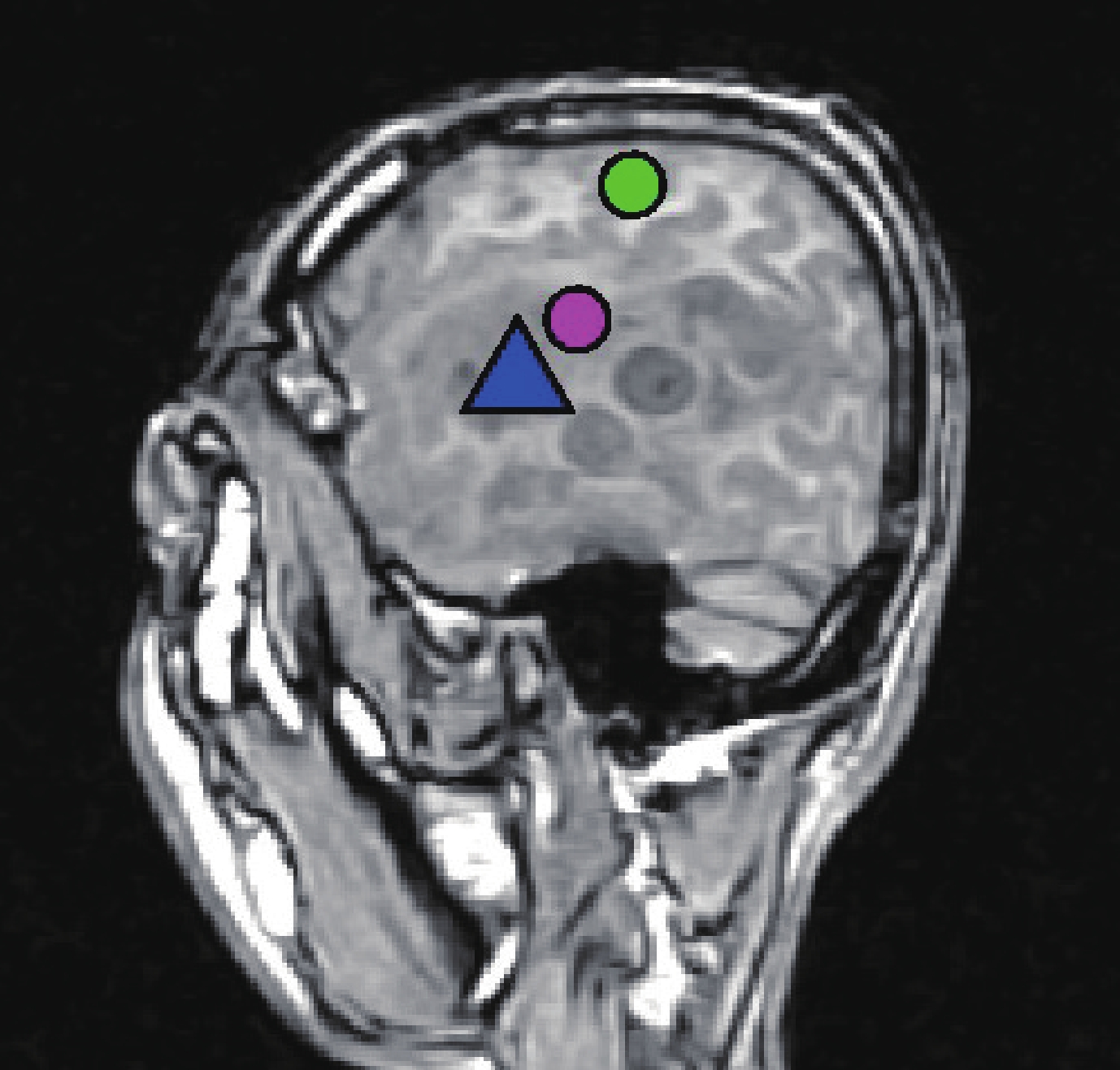
全部患者應用腦磁圖(MEG)檢查。芬蘭 Neuromeg 公司的 MEG-Segmentation 軟件對腦 MRI 原始圖像行三維重建,獲得腦三維立體圖像。采用芬蘭 Neuromeg 公司的 MEG-MRI Integration 軟件將 MEG 所獲得的腦功能信息與 MRI 獲得的解剖結構圖像進行疊加融合,呈現腦功能圖像(圖 1)。
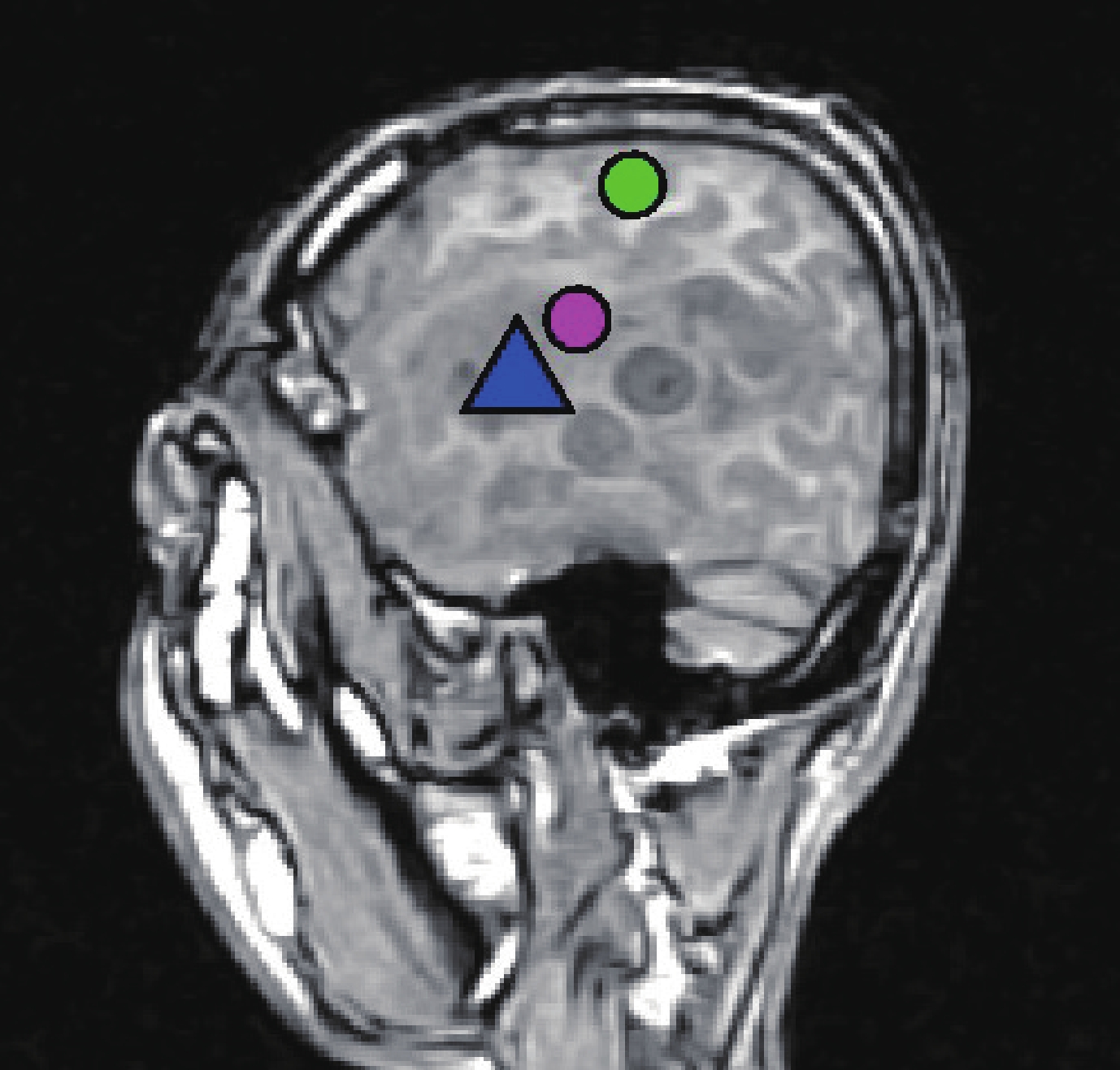 圖1
腦磁圖左額顳膠質瘤
圖1
腦磁圖左額顳膠質瘤
:軀體運動中樞;
:聽覺中樞;
:聽覺性語言中樞
: somatomotor center;
: somatosensory center;
: auditory language center.
1.5 手術方法
全部患者應用美國 Medtronic Stealhealth S7 手術導航系統。術前采集 CT、MRI、DTI、MRA、MEG 等信息,術前神經導航勾畫確定切除范圍和功能區保護范圍,包括腫瘤、致癇灶、功能區、重要神經纖維、血管結構等(圖 2), 預設計手術入路。
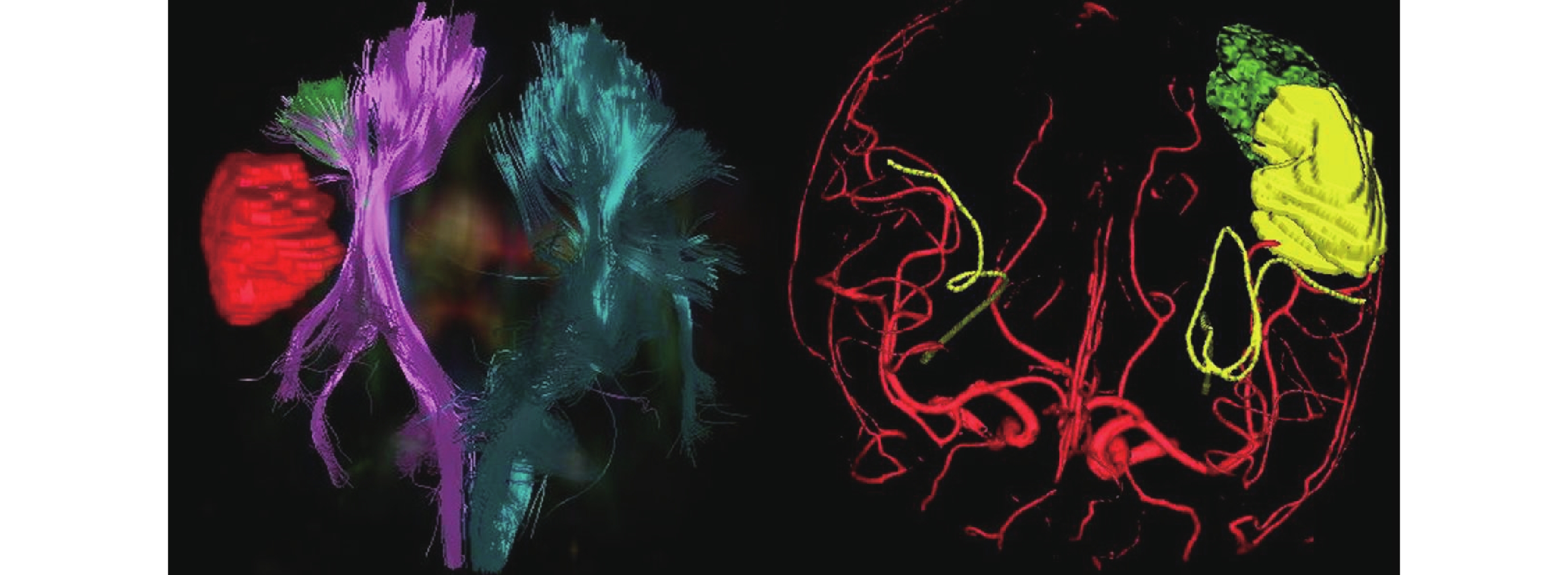 圖2
神經導航融合圖像顯示右額顳膠質瘤,彌散張量成像提示右側錐體束受損,磁共振血管成像顯示血管推擠移位
Figure2.
Right frontotemporal glioma wad showed in neuronavigation fusion images. Diffusion tensor imaging (DTI) showed right pyramidal tract damage, and magnetic resonance angiography (MRA) showed that the blood vessels were pushed and displaced
圖2
神經導航融合圖像顯示右額顳膠質瘤,彌散張量成像提示右側錐體束受損,磁共振血管成像顯示血管推擠移位
Figure2.
Right frontotemporal glioma wad showed in neuronavigation fusion images. Diffusion tensor imaging (DTI) showed right pyramidal tract damage, and magnetic resonance angiography (MRA) showed that the blood vessels were pushed and displaced
患者常規開顱,剪開硬膜,按神經導航指引結合大腦皮層溝回解剖結構,初步確定手術切除區域及手術入路。術中超聲儀器選用 GE-Logiq 5 彩色多普勒超聲儀,隨機配備 8c 凸陣術中專用探頭,探頭頻率 5.0~10.0 MHz。超聲探頭上涂抹耦合劑,外包無菌塑料保護套,置于腦組織表面,進行冠狀、矢狀、水平等多平面探測;在導航的基礎上進行超聲觀察血管、腫瘤情況,再次確定手術入路及切除范圍。
顯微鏡下按照手術計劃切除腫瘤及致癇灶,妥善止血清理術腔。術腔內注滿生理鹽水,再次將超聲探頭置于術腔,行超聲掃描確定切除范圍。如果發現有異常聲影需擴大切除范圍者,再次切除。再次切除后的組織單獨留取病理標本,以便術后驗證并分析患者術中超聲表現及定位意義。
患者行腫瘤切除術的同時行致癲灶切除,腫瘤切除前后均在神經導航、術中超聲技術指導下進行皮層 EEG 監測,達到最大程度切除致癲灶。功能區監測到的異常放電灶,行皮層熱灼,至異常放電消失為止。
2 結果
2.1 術中所見及病理
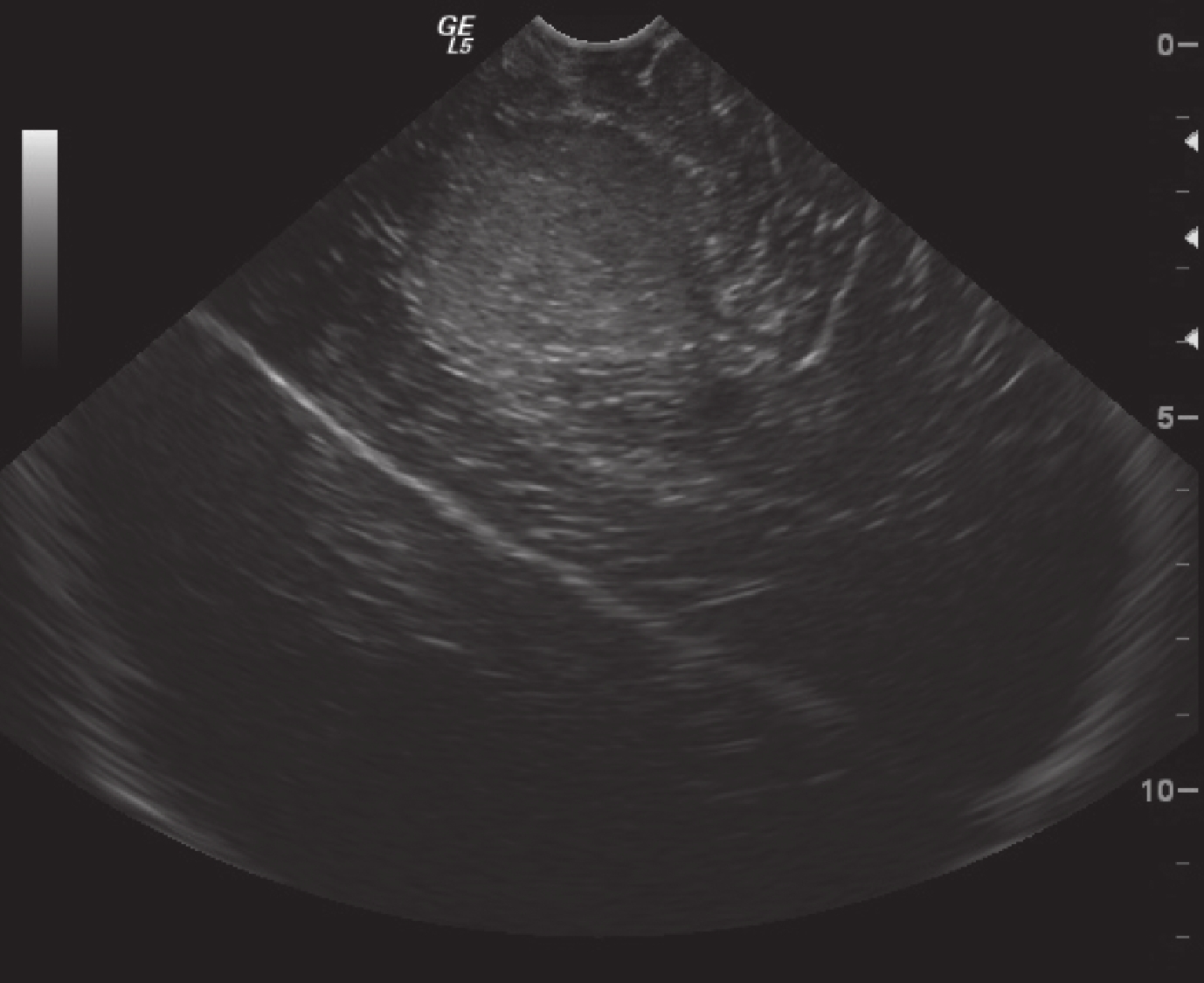
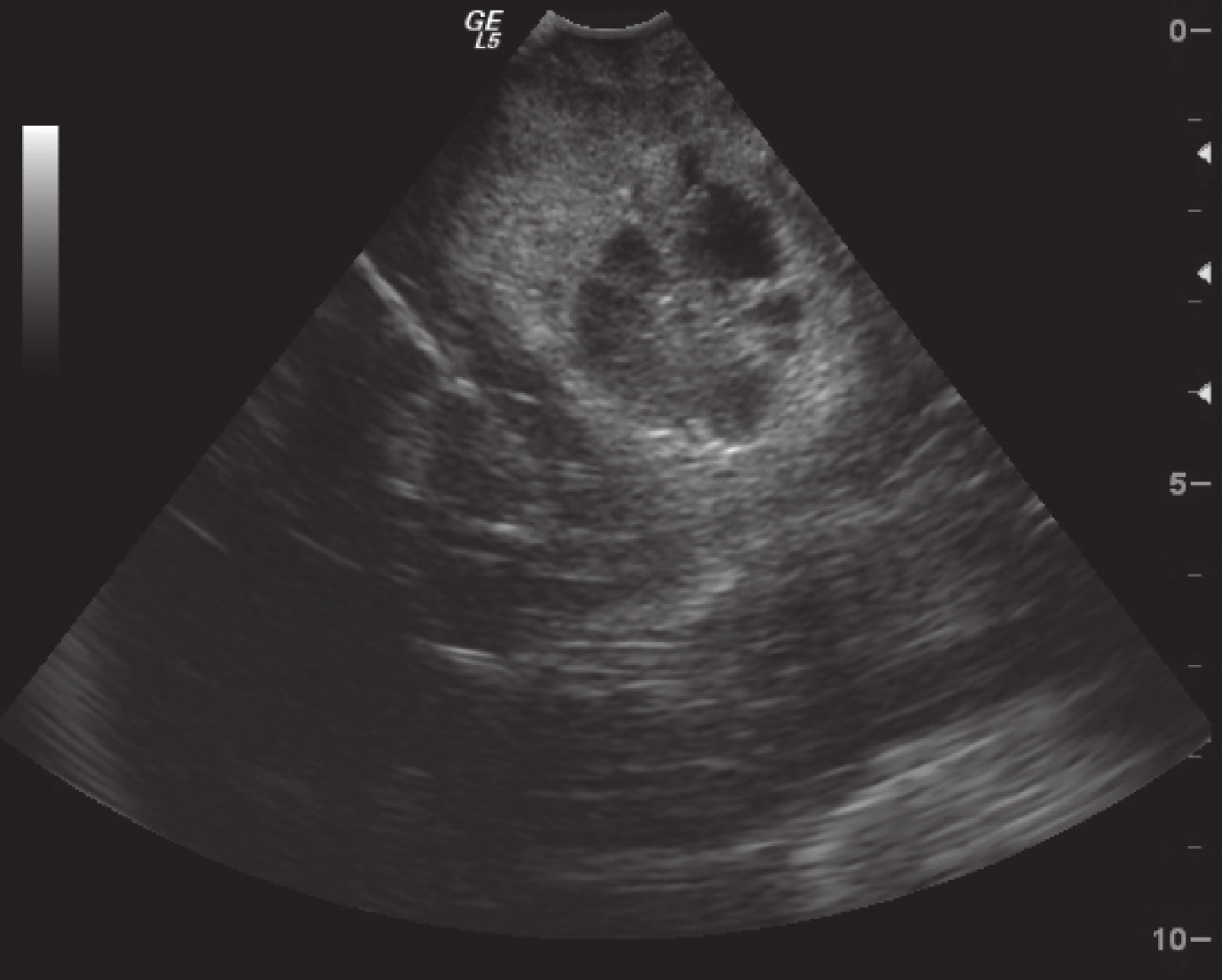
正常腦組織在術中超聲表現為均勻的低回聲區,腦室及腦脊液表現為無回聲區。術中超聲監測膠質瘤直徑 2.5~11.4 cm,平均(5.3±2.1)cm,較術前 MRI 測量的體積稍大。低級別膠質瘤的術中超聲表現為局限性稍高回聲區,邊界清晰,形態較為規整,內部回聲較為均勻,瘤周輕度水腫,部分伴有點狀強回聲的鈣化灶,后方多不伴有聲影(圖 3)。高級別膠質瘤在術中超聲表現為彌漫性高回聲區,邊界不清,形態多數不規則,內部常伴有低回聲或無回聲的壞死囊變區,瘤周水腫較為明顯,腫瘤內部很少有鈣化的強回聲(圖 4)。
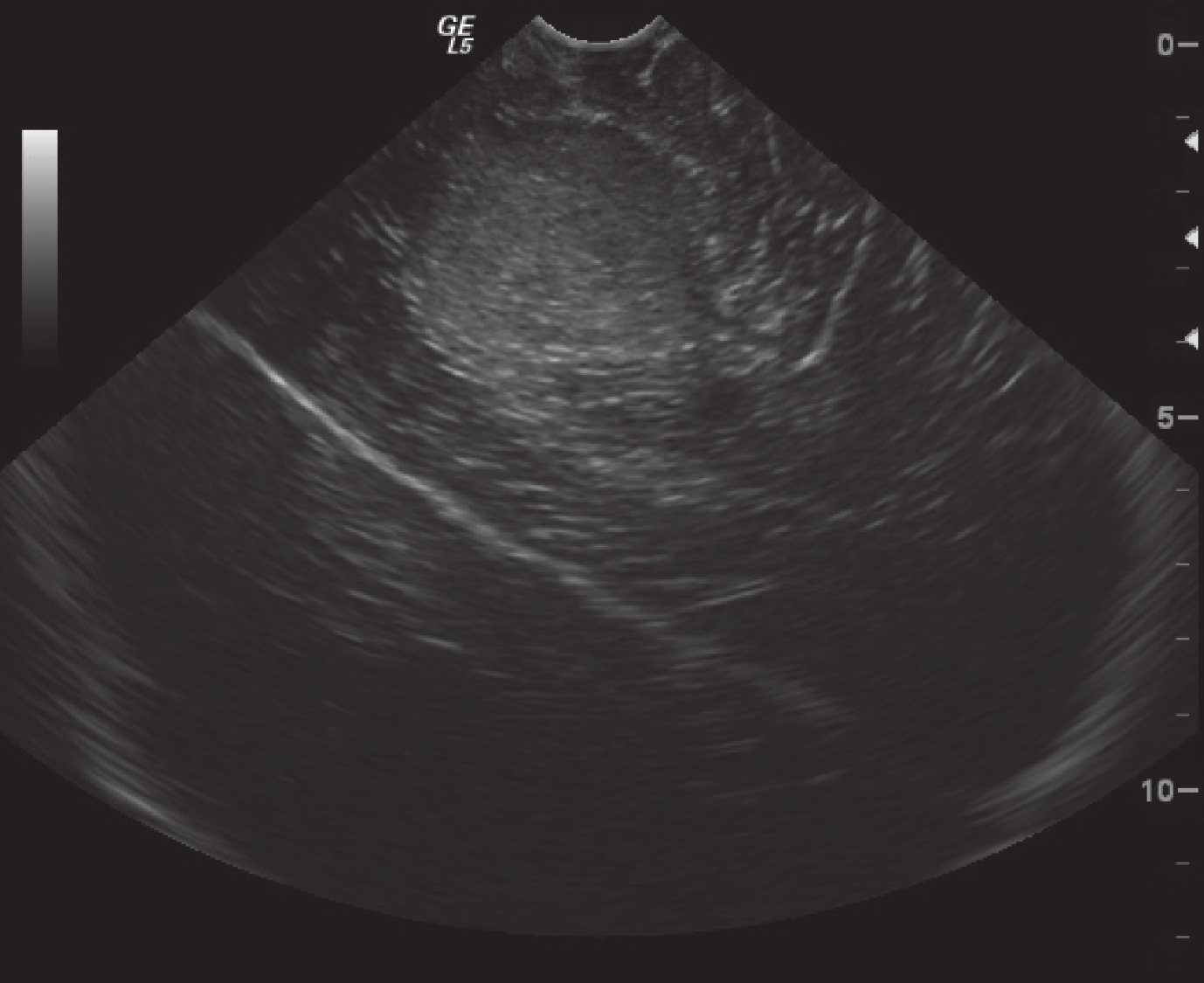 圖3
超聲顯示低級別星形細胞瘤局限性稍高回聲區,邊界清晰,內部回聲較均勻
Figure3.
Ultrasonography of low-grade astrocytoma showed low slightly hyperechoic areas with clear borders and homogeneous internal echoes
圖3
超聲顯示低級別星形細胞瘤局限性稍高回聲區,邊界清晰,內部回聲較均勻
Figure3.
Ultrasonography of low-grade astrocytoma showed low slightly hyperechoic areas with clear borders and homogeneous internal echoes
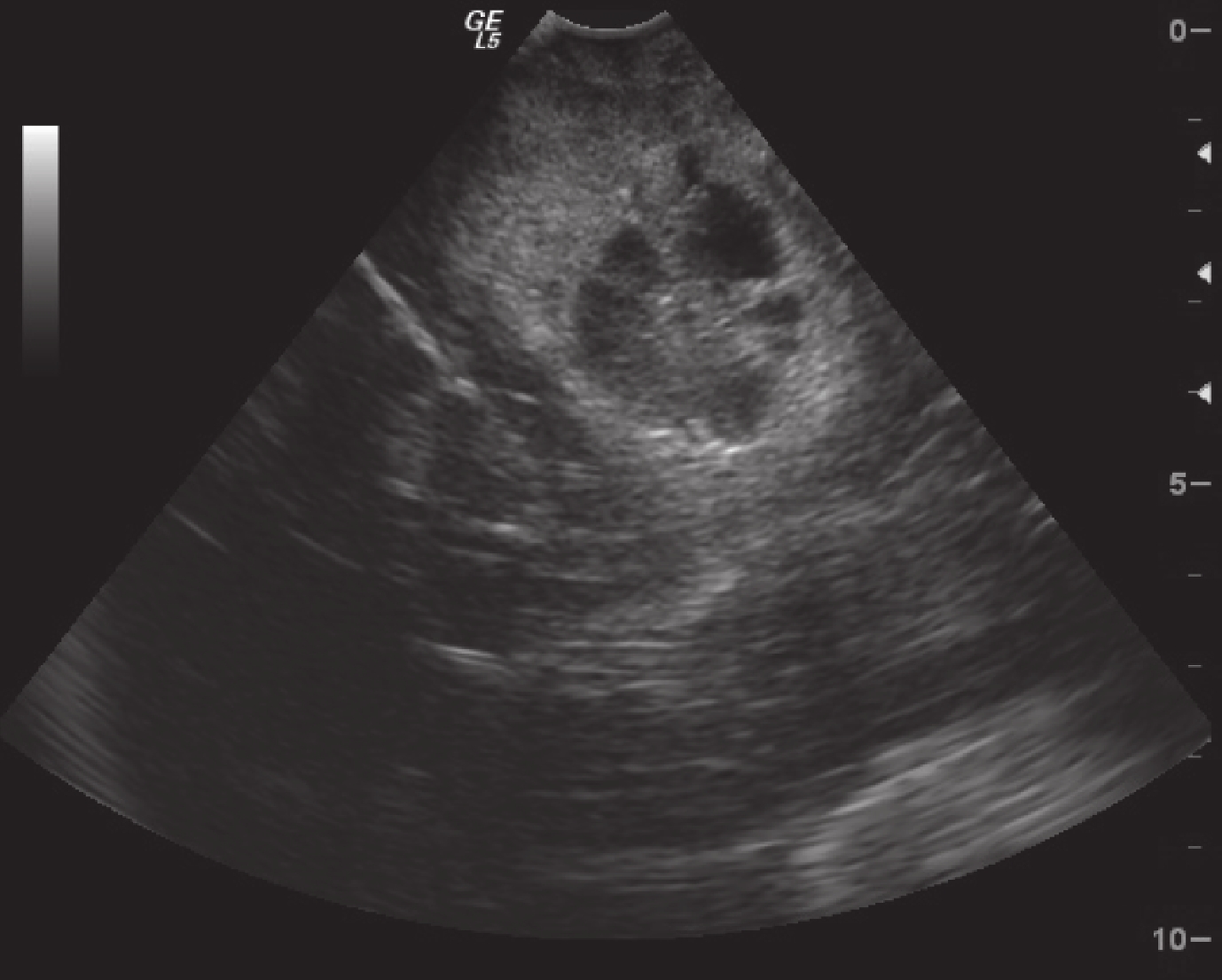 圖4
超聲顯示膠質母細胞瘤彌漫性高回聲區,邊界不清,內部低回聲壞死囊變區
Figure4.
Ultrasonography showed that glioblastoma was a diffuse hyperechoic area with unclear boundary, while the necrotic cystic area was hypoechoic
圖4
超聲顯示膠質母細胞瘤彌漫性高回聲區,邊界不清,內部低回聲壞死囊變區
Figure4.
Ultrasonography showed that glioblastoma was a diffuse hyperechoic area with unclear boundary, while the necrotic cystic area was hypoechoic
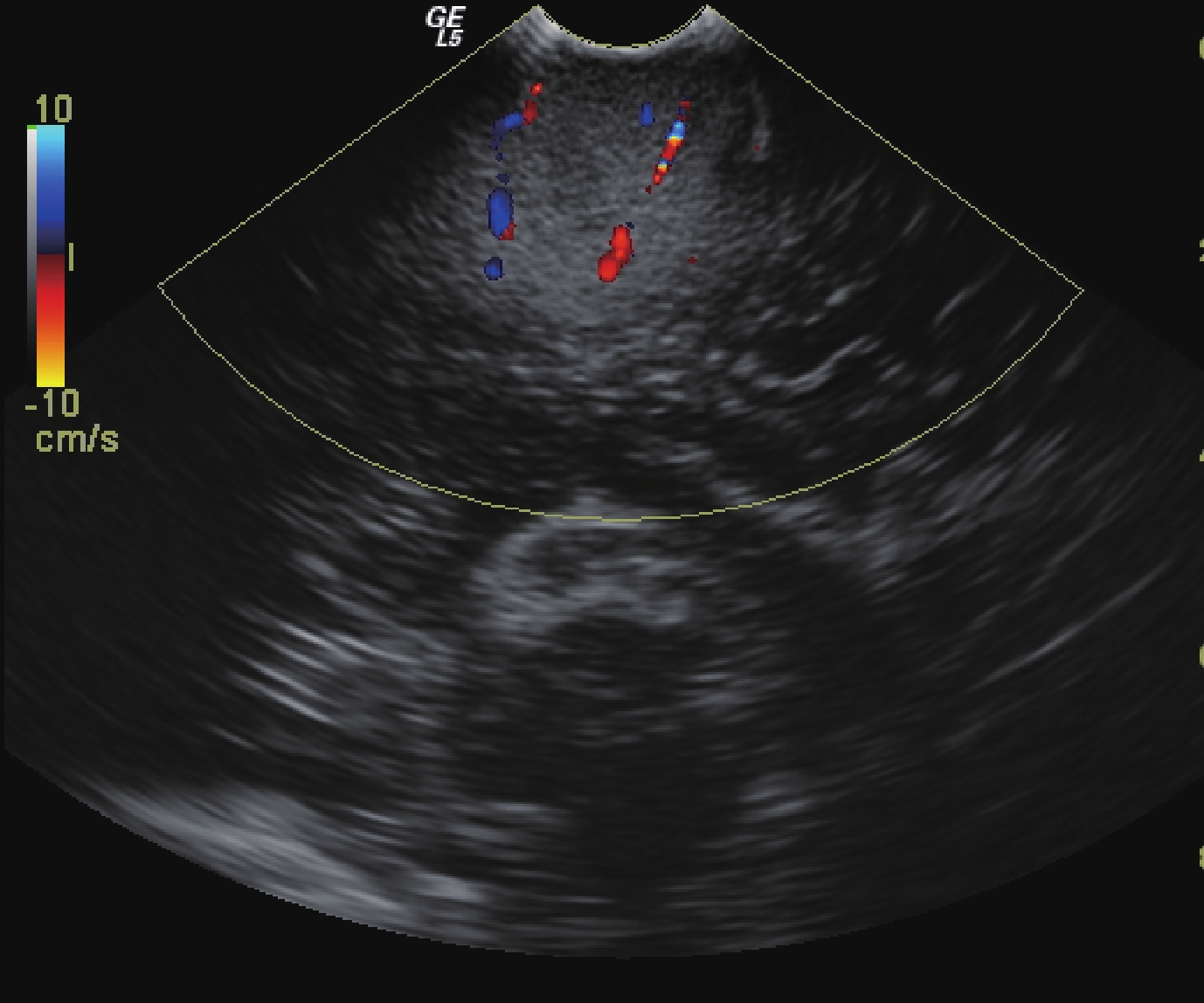
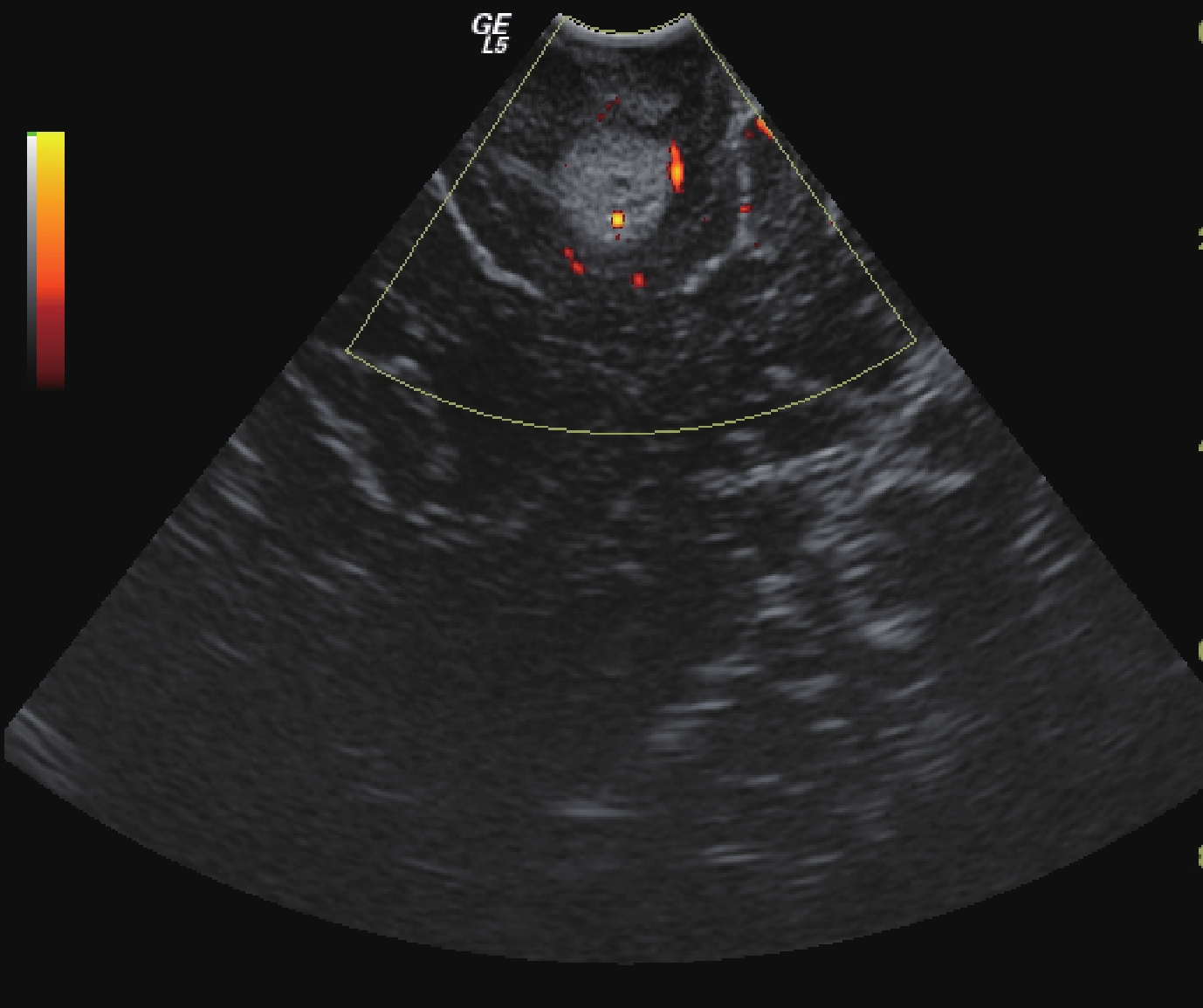
47 例膠質瘤手術切除前均在神經導航的基礎上進行了超聲監測,發現其中 9 例膠質瘤的周邊有大血管環繞或緊鄰(圖 5),因此調整了手術入路;9 例患者均為高級別膠質瘤。依照神經導航設計范圍切除腫瘤后,行術中超聲檢查,發現 18 例有殘余腫瘤(圖 6),需再次切除;其中低級別膠質瘤 8 例,高級別膠質瘤 10 例;殘余腫瘤直徑 1.2~4.3 cm,平均(2.4±0.4)cm。經術后病理驗證,再次切除的部分均存在腫瘤細胞。
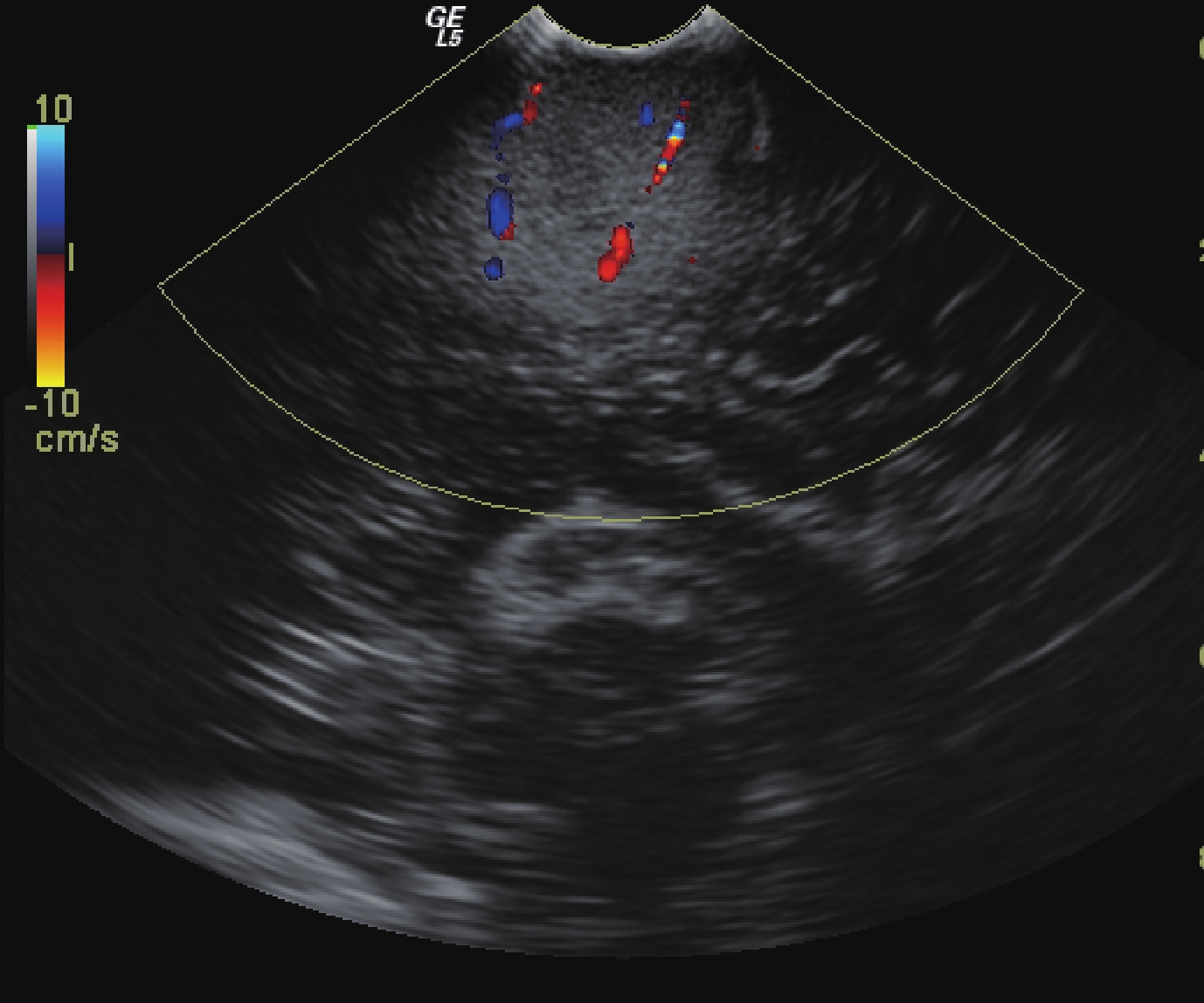 圖5
超聲顯示膠質瘤周邊包繞血管,需側方位入路切除
Figure5.
Ultrasonography showed that the glioma was surrounded by blood vessels and lateral approach was needed to resect it
圖5
超聲顯示膠質瘤周邊包繞血管,需側方位入路切除
Figure5.
Ultrasonography showed that the glioma was surrounded by blood vessels and lateral approach was needed to resect it
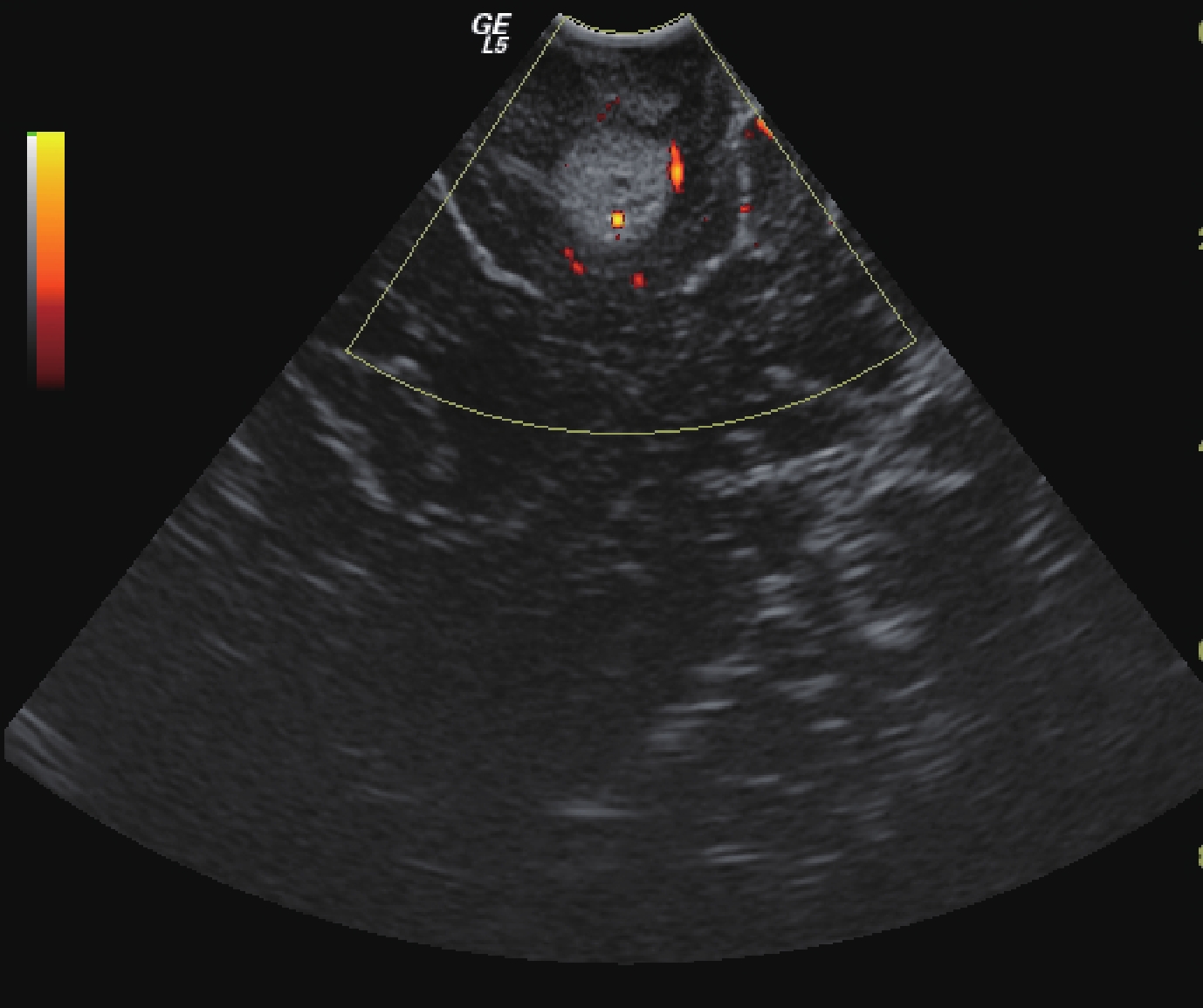 圖6
術中超聲顯示切除術仍有少量殘留,仍需進一步切除
Figure6.
Intraoperative Ultrasonography showed tumor residual, which needed further resection
圖6
術中超聲顯示切除術仍有少量殘留,仍需進一步切除
Figure6.
Intraoperative Ultrasonography showed tumor residual, which needed further resection
全部患者術后均無血腫、感染、偏癱、失語出現。術后 48 h 復查 MRI,與術前腫瘤對比切除程度。MRI 顯示腫瘤全切 34 例,大部切除 13 例。術后病理報告示低級別膠質瘤 36 例,高級別膠質瘤 11 例。病理類型見表 1。
2.2 腫瘤序貫治療及隨訪
低級別膠質瘤顯微鏡下全切除患者,根據以下 7 個條件進行篩選:① 星形細胞瘤;② 腫瘤直徑超過 6 cm;③ 腫瘤過中線;④ 年齡>40 歲;⑤ KPS<70;⑥ 術前神經功能明顯受損;⑦ 未發現 1p19q 聯合缺失或 IDH1\IDH2 突變者。若滿足 3 個條件及以上為高危,行術后輔助放療。其余做定期復查,暫不做進一步治療。低級別膠質瘤若術后有殘留,行三維適形放療,50 Gy/20 次,5 次/周。
高級別膠質瘤患者術后均輔助放化療。膠質瘤邊界外擴 2 cm 放療 40 Gy/20 次,5 次/周,同步配合小劑量替莫唑胺(TMZ)化療,50 mg/(m2·d),7 d/周。完成首程放射治療計劃后再次定位,區域縮野照射 20 Gy/10 次,5 次/周,患者放療終止 28 d 后,進行大劑量 TMZ 化療,1 000 mg/(m2·d),持續 5 d,28 d 為 1 個周期,共 6 個周期。化療期間注意監測全血細胞計數(CBC)、肝、腎功能指標,及時對癥處理。
47 例患者獲隨訪 13~47 個月,平均 28.6 個月。4 例星形膠質細胞瘤Ⅳ級患者分別于治療后 7~21 個月死亡。2 例少突膠質細胞瘤、6 例星形膠質細胞瘤Ⅲ級患者于術后 15~29 個月腫瘤復發,再次手術切除;截止撰文之日星形膠質細胞瘤Ⅲ級患者死亡 3 例。其余患者腫瘤控制良好,未見腫瘤復發征象。
2.3 癲癇治療評估
全部患者術后規律服用抗癲癇藥物(AEDs),定期復查 VEEG、血藥濃度、肝腎功能等檢查。術后 1 年評估癲癇控制情況,Engel’sⅠ級 17 例,Engel’sⅡ級 20 例,Engel’s Ⅲ級 10 例。
3 討論
膠質瘤是顱內最常見的惡性腫瘤,其治療方式以手術為主、配合放化療的綜合治療,腫瘤的切除程度是決定生存期的關鍵。而膠質瘤和正常腦組織分界不清,造成手術切除不徹底是復發率較高的重要因素。神經導航能對患者病變部位進行術前定位,可以此為參考準確找到并切除腫瘤,臨床已經廣泛應用。但由于術中腦脊液的丟失,脫水劑的應用,以及腦組織重力的影響等因素,往往容易造成腦組織結構移位,導致導航精確度下降。再者,部分膠質瘤術前 MRI 影像與正常腦組織分界不清,神經導航也容易出現偏差[1]。術中超聲具有可反復掃查、實時定位的優點,能準確判斷病灶的位置、病灶和手術切緣的關系以及病灶切除的范圍,同時超聲能夠及時糾正腦組織移位的方向和距離,實時了解腫瘤內部及周邊血管的走行情況,這些均是神經導航系統不能比擬的[2, 3]。
本組 47 例膠質瘤患者術前在神經導航的基礎上均進行了超聲監測,確定膠質瘤的邊界,以及與血管的毗鄰關系,發現 9 例膠質瘤的內部或周邊血運豐富或毗鄰重要血管,在術中超聲實時引導下調整了手術入路,避免大血管及重要功能區的損傷。此 9 例膠質瘤患者術后病理均為高級別膠質瘤,原因可能是膠質瘤血管生成程度與腫瘤的惡性程度有關,級別越高的膠質瘤新生血管密度越大。瘤周水腫是膠質瘤的一大特征,高級別膠質瘤的水腫更為明顯,對周圍的腦組織壓迫程度嚴重,更容易造成血管移位。MRI 對腦水腫與膠質瘤界限不易區分,易致水腫組織過度切除而帶來不必要的損害。在超聲的引導下可以區分腦組織水腫與膠質瘤。在保留神經功能的同時實施腫瘤根治術可提高臨床治療有效率[4]。
依照神經導航術前設計切除膠質瘤后,再行術中超聲檢查,發現膠質瘤惡性程度越高,對周圍組織的浸潤越嚴重,與周圍正常組織的界限不清越明顯,手術殘留率明顯較高[5, 6]。通過術中超聲對疑似殘留的組織再次切除并送病理檢查,大大提高了膠質瘤的全切率[5, 7]。
但術中超聲影像容易受操作者技巧、設備參數、術野情況等多種因素的影響,存在空間性、對比性差的缺點。相信隨著更小、分辨率更高的探頭出現,超聲影像清晰度的提高,超聲與神經導航、神經內鏡、熒光顯像等技術有效的結合,切除膠質瘤術中超聲的應用將會更加完善[8-11]。
伴發癲癇的膠質瘤患者的手術,單純切除腫瘤對于癲癇的控制是遠遠不夠的,需要將致癇灶一并切除。有時致癇灶的切除對于癲癇患者來說比膠質瘤病灶的切除更為重要[12]。只有通過縝密的術前評估、明確致癲灶與膠質瘤的位置關系,切除膠質瘤并清除致癇灶,才能控制癲癇發作。通過擴大范圍切除膠質瘤來治療癲癇的方法是不正確的[13]。
MEG 對癲癇患者術前語言、運動、感覺區精確定位評估具有重要價值,MEG 指導功能區癲癇手術入路設計,與神經導航結合應用于手術,則既可顯示膠質瘤位置,又可反映了癲癲灶和腦功能區域[14]。神經導航系統與 MEG 圖像資料進行融合,通過觀察棒的指引,在實際解剖部位區顯示功能圖像,為避免術后出現語言、記憶、運動、感覺等神經功能障礙提供了重要信息[15-17]。
神經導航系統目前已由單純解剖導航向功能導航方向發展,通過對 CT、MRI、MEG 等多種影像資料融合后的神經導航,可以在術前對腦腫瘤、致癇灶位置及鄰近重要功能區進行準確定位,確定邊界,合理規劃手術切口及入路,避開重要功能結構[18-20]; 術中聯合超聲能夠實時定位示蹤,實現最大程度切除腫瘤及致癇灶,降低術后神經功能障礙的發生率。
腦膠質瘤是最常見的中樞神經系統腫瘤,很多患者因伴發癲癇就診。伴發癲癇的腦膠質瘤首要治療方法是手術切除。但術中常存在腫瘤邊界不清、與重要功能區或致癇灶關系密切難以切除等問題。本研究回顧性分析了 2012 年 6 月 30 日—2014 年 6 月 30 日期間于河北省人民醫院神經外科行手術切除的 47 例伴發癲癇的腦膠質瘤患者臨床資料,對神經導航聯合術中超聲在切除伴發癲癇的腦膠質瘤中的應用價值,并進行總結分析,為相關疾病的外科手術治療提供參考。
1 資料與方法
1.1 一般資料
收集 2012 年 6 月 30 日—2014 年 6 月 30 日在河北省人民醫院神經外科行手術治療的腦膠質瘤伴發癲癇患者 47 例。其中男 31 例,女 16 例;年齡 14~71 歲,平均(53.2±10.6)歲。
1.2 臨床表現
全部患者至少有 1 次癲癇發作史,其中 29 例首發癥狀為癲癇。發作類型:復雜部分性癲癇發作 11 例,簡單部分性發作 17 例,全面性強直陣攣性發作 19 例。26 例伴頭痛、眼底水腫,13 例存在肢體麻木、無力癥狀,4 例有視野缺損。14 例神經系統查體陰性。
1.3 影像學檢查
全部患者均行斷層掃描(CT)、核磁共振(MRI)、彌散張量成像(DTI)、磁共振血管成像(MRA)檢查。腫瘤位于額葉 23 例、顳葉 11 例、枕葉 4 例、頂葉 2 例、多腦葉 7 例。MRI 測量病灶直徑 2.4~11.3 cm,平均(6.7±1.5)cm。
1.4 致癇灶定位
全部患者應用美國 Nicolet 64 導視頻腦電(VEEG)監測系統,按照國際 10/20 系統安置電極,描記清醒、睡眠期腦電圖(EEG),捕捉發作期 EEG 5~7 次,根據發作間期和發作期異常放電,結合發作期臨床表現,定位致癇灶。
全部患者應用腦磁圖(MEG)檢查。芬蘭 Neuromeg 公司的 MEG-Segmentation 軟件對腦 MRI 原始圖像行三維重建,獲得腦三維立體圖像。采用芬蘭 Neuromeg 公司的 MEG-MRI Integration 軟件將 MEG 所獲得的腦功能信息與 MRI 獲得的解剖結構圖像進行疊加融合,呈現腦功能圖像(圖 1)。
 圖1
腦磁圖左額顳膠質瘤
圖1
腦磁圖左額顳膠質瘤
:軀體運動中樞;
:聽覺中樞;
:聽覺性語言中樞
: somatomotor center;
: somatosensory center;
: auditory language center.
1.5 手術方法
全部患者應用美國 Medtronic Stealhealth S7 手術導航系統。術前采集 CT、MRI、DTI、MRA、MEG 等信息,術前神經導航勾畫確定切除范圍和功能區保護范圍,包括腫瘤、致癇灶、功能區、重要神經纖維、血管結構等(圖 2), 預設計手術入路。
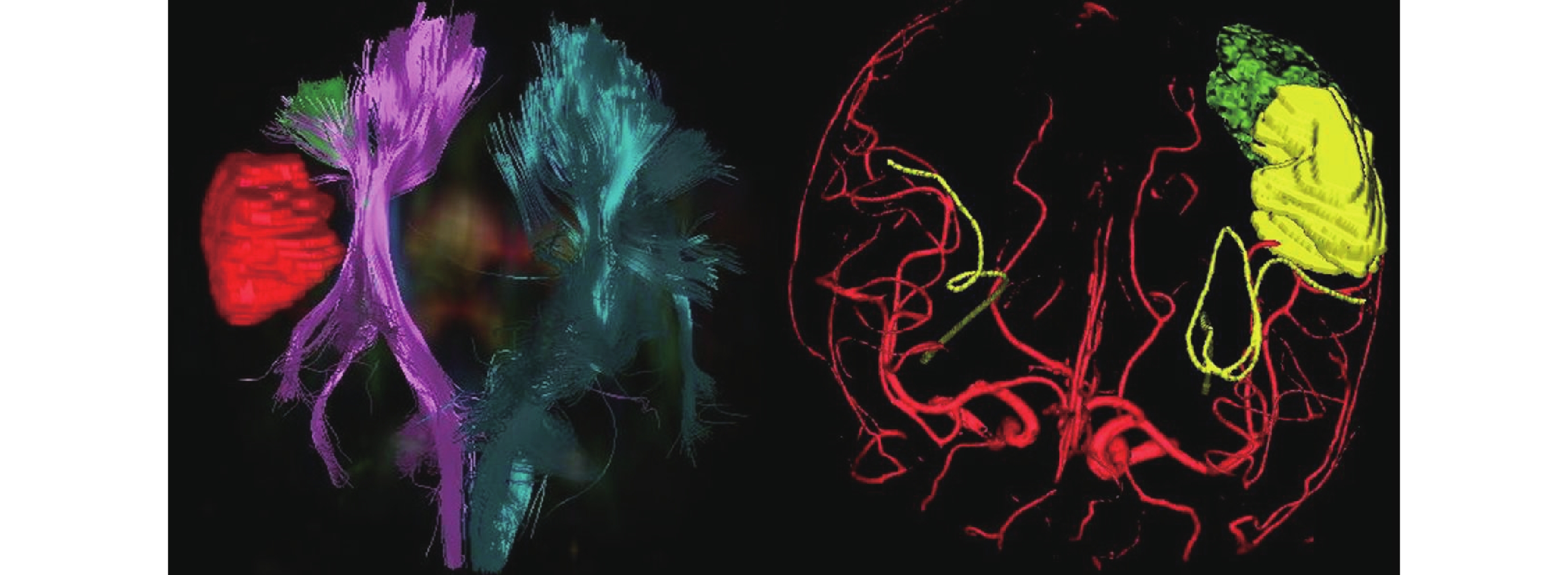 圖2
神經導航融合圖像顯示右額顳膠質瘤,彌散張量成像提示右側錐體束受損,磁共振血管成像顯示血管推擠移位
Figure2.
Right frontotemporal glioma wad showed in neuronavigation fusion images. Diffusion tensor imaging (DTI) showed right pyramidal tract damage, and magnetic resonance angiography (MRA) showed that the blood vessels were pushed and displaced
圖2
神經導航融合圖像顯示右額顳膠質瘤,彌散張量成像提示右側錐體束受損,磁共振血管成像顯示血管推擠移位
Figure2.
Right frontotemporal glioma wad showed in neuronavigation fusion images. Diffusion tensor imaging (DTI) showed right pyramidal tract damage, and magnetic resonance angiography (MRA) showed that the blood vessels were pushed and displaced
患者常規開顱,剪開硬膜,按神經導航指引結合大腦皮層溝回解剖結構,初步確定手術切除區域及手術入路。術中超聲儀器選用 GE-Logiq 5 彩色多普勒超聲儀,隨機配備 8c 凸陣術中專用探頭,探頭頻率 5.0~10.0 MHz。超聲探頭上涂抹耦合劑,外包無菌塑料保護套,置于腦組織表面,進行冠狀、矢狀、水平等多平面探測;在導航的基礎上進行超聲觀察血管、腫瘤情況,再次確定手術入路及切除范圍。
顯微鏡下按照手術計劃切除腫瘤及致癇灶,妥善止血清理術腔。術腔內注滿生理鹽水,再次將超聲探頭置于術腔,行超聲掃描確定切除范圍。如果發現有異常聲影需擴大切除范圍者,再次切除。再次切除后的組織單獨留取病理標本,以便術后驗證并分析患者術中超聲表現及定位意義。
患者行腫瘤切除術的同時行致癲灶切除,腫瘤切除前后均在神經導航、術中超聲技術指導下進行皮層 EEG 監測,達到最大程度切除致癲灶。功能區監測到的異常放電灶,行皮層熱灼,至異常放電消失為止。
2 結果
2.1 術中所見及病理
正常腦組織在術中超聲表現為均勻的低回聲區,腦室及腦脊液表現為無回聲區。術中超聲監測膠質瘤直徑 2.5~11.4 cm,平均(5.3±2.1)cm,較術前 MRI 測量的體積稍大。低級別膠質瘤的術中超聲表現為局限性稍高回聲區,邊界清晰,形態較為規整,內部回聲較為均勻,瘤周輕度水腫,部分伴有點狀強回聲的鈣化灶,后方多不伴有聲影(圖 3)。高級別膠質瘤在術中超聲表現為彌漫性高回聲區,邊界不清,形態多數不規則,內部常伴有低回聲或無回聲的壞死囊變區,瘤周水腫較為明顯,腫瘤內部很少有鈣化的強回聲(圖 4)。
 圖3
超聲顯示低級別星形細胞瘤局限性稍高回聲區,邊界清晰,內部回聲較均勻
Figure3.
Ultrasonography of low-grade astrocytoma showed low slightly hyperechoic areas with clear borders and homogeneous internal echoes
圖3
超聲顯示低級別星形細胞瘤局限性稍高回聲區,邊界清晰,內部回聲較均勻
Figure3.
Ultrasonography of low-grade astrocytoma showed low slightly hyperechoic areas with clear borders and homogeneous internal echoes
 圖4
超聲顯示膠質母細胞瘤彌漫性高回聲區,邊界不清,內部低回聲壞死囊變區
Figure4.
Ultrasonography showed that glioblastoma was a diffuse hyperechoic area with unclear boundary, while the necrotic cystic area was hypoechoic
圖4
超聲顯示膠質母細胞瘤彌漫性高回聲區,邊界不清,內部低回聲壞死囊變區
Figure4.
Ultrasonography showed that glioblastoma was a diffuse hyperechoic area with unclear boundary, while the necrotic cystic area was hypoechoic
47 例膠質瘤手術切除前均在神經導航的基礎上進行了超聲監測,發現其中 9 例膠質瘤的周邊有大血管環繞或緊鄰(圖 5),因此調整了手術入路;9 例患者均為高級別膠質瘤。依照神經導航設計范圍切除腫瘤后,行術中超聲檢查,發現 18 例有殘余腫瘤(圖 6),需再次切除;其中低級別膠質瘤 8 例,高級別膠質瘤 10 例;殘余腫瘤直徑 1.2~4.3 cm,平均(2.4±0.4)cm。經術后病理驗證,再次切除的部分均存在腫瘤細胞。
 圖5
超聲顯示膠質瘤周邊包繞血管,需側方位入路切除
Figure5.
Ultrasonography showed that the glioma was surrounded by blood vessels and lateral approach was needed to resect it
圖5
超聲顯示膠質瘤周邊包繞血管,需側方位入路切除
Figure5.
Ultrasonography showed that the glioma was surrounded by blood vessels and lateral approach was needed to resect it
 圖6
術中超聲顯示切除術仍有少量殘留,仍需進一步切除
Figure6.
Intraoperative Ultrasonography showed tumor residual, which needed further resection
圖6
術中超聲顯示切除術仍有少量殘留,仍需進一步切除
Figure6.
Intraoperative Ultrasonography showed tumor residual, which needed further resection
全部患者術后均無血腫、感染、偏癱、失語出現。術后 48 h 復查 MRI,與術前腫瘤對比切除程度。MRI 顯示腫瘤全切 34 例,大部切除 13 例。術后病理報告示低級別膠質瘤 36 例,高級別膠質瘤 11 例。病理類型見表 1。
2.2 腫瘤序貫治療及隨訪
低級別膠質瘤顯微鏡下全切除患者,根據以下 7 個條件進行篩選:① 星形細胞瘤;② 腫瘤直徑超過 6 cm;③ 腫瘤過中線;④ 年齡>40 歲;⑤ KPS<70;⑥ 術前神經功能明顯受損;⑦ 未發現 1p19q 聯合缺失或 IDH1\IDH2 突變者。若滿足 3 個條件及以上為高危,行術后輔助放療。其余做定期復查,暫不做進一步治療。低級別膠質瘤若術后有殘留,行三維適形放療,50 Gy/20 次,5 次/周。
高級別膠質瘤患者術后均輔助放化療。膠質瘤邊界外擴 2 cm 放療 40 Gy/20 次,5 次/周,同步配合小劑量替莫唑胺(TMZ)化療,50 mg/(m2·d),7 d/周。完成首程放射治療計劃后再次定位,區域縮野照射 20 Gy/10 次,5 次/周,患者放療終止 28 d 后,進行大劑量 TMZ 化療,1 000 mg/(m2·d),持續 5 d,28 d 為 1 個周期,共 6 個周期。化療期間注意監測全血細胞計數(CBC)、肝、腎功能指標,及時對癥處理。
47 例患者獲隨訪 13~47 個月,平均 28.6 個月。4 例星形膠質細胞瘤Ⅳ級患者分別于治療后 7~21 個月死亡。2 例少突膠質細胞瘤、6 例星形膠質細胞瘤Ⅲ級患者于術后 15~29 個月腫瘤復發,再次手術切除;截止撰文之日星形膠質細胞瘤Ⅲ級患者死亡 3 例。其余患者腫瘤控制良好,未見腫瘤復發征象。
2.3 癲癇治療評估
全部患者術后規律服用抗癲癇藥物(AEDs),定期復查 VEEG、血藥濃度、肝腎功能等檢查。術后 1 年評估癲癇控制情況,Engel’sⅠ級 17 例,Engel’sⅡ級 20 例,Engel’s Ⅲ級 10 例。
3 討論
膠質瘤是顱內最常見的惡性腫瘤,其治療方式以手術為主、配合放化療的綜合治療,腫瘤的切除程度是決定生存期的關鍵。而膠質瘤和正常腦組織分界不清,造成手術切除不徹底是復發率較高的重要因素。神經導航能對患者病變部位進行術前定位,可以此為參考準確找到并切除腫瘤,臨床已經廣泛應用。但由于術中腦脊液的丟失,脫水劑的應用,以及腦組織重力的影響等因素,往往容易造成腦組織結構移位,導致導航精確度下降。再者,部分膠質瘤術前 MRI 影像與正常腦組織分界不清,神經導航也容易出現偏差[1]。術中超聲具有可反復掃查、實時定位的優點,能準確判斷病灶的位置、病灶和手術切緣的關系以及病灶切除的范圍,同時超聲能夠及時糾正腦組織移位的方向和距離,實時了解腫瘤內部及周邊血管的走行情況,這些均是神經導航系統不能比擬的[2, 3]。
本組 47 例膠質瘤患者術前在神經導航的基礎上均進行了超聲監測,確定膠質瘤的邊界,以及與血管的毗鄰關系,發現 9 例膠質瘤的內部或周邊血運豐富或毗鄰重要血管,在術中超聲實時引導下調整了手術入路,避免大血管及重要功能區的損傷。此 9 例膠質瘤患者術后病理均為高級別膠質瘤,原因可能是膠質瘤血管生成程度與腫瘤的惡性程度有關,級別越高的膠質瘤新生血管密度越大。瘤周水腫是膠質瘤的一大特征,高級別膠質瘤的水腫更為明顯,對周圍的腦組織壓迫程度嚴重,更容易造成血管移位。MRI 對腦水腫與膠質瘤界限不易區分,易致水腫組織過度切除而帶來不必要的損害。在超聲的引導下可以區分腦組織水腫與膠質瘤。在保留神經功能的同時實施腫瘤根治術可提高臨床治療有效率[4]。
依照神經導航術前設計切除膠質瘤后,再行術中超聲檢查,發現膠質瘤惡性程度越高,對周圍組織的浸潤越嚴重,與周圍正常組織的界限不清越明顯,手術殘留率明顯較高[5, 6]。通過術中超聲對疑似殘留的組織再次切除并送病理檢查,大大提高了膠質瘤的全切率[5, 7]。
但術中超聲影像容易受操作者技巧、設備參數、術野情況等多種因素的影響,存在空間性、對比性差的缺點。相信隨著更小、分辨率更高的探頭出現,超聲影像清晰度的提高,超聲與神經導航、神經內鏡、熒光顯像等技術有效的結合,切除膠質瘤術中超聲的應用將會更加完善[8-11]。
伴發癲癇的膠質瘤患者的手術,單純切除腫瘤對于癲癇的控制是遠遠不夠的,需要將致癇灶一并切除。有時致癇灶的切除對于癲癇患者來說比膠質瘤病灶的切除更為重要[12]。只有通過縝密的術前評估、明確致癲灶與膠質瘤的位置關系,切除膠質瘤并清除致癇灶,才能控制癲癇發作。通過擴大范圍切除膠質瘤來治療癲癇的方法是不正確的[13]。
MEG 對癲癇患者術前語言、運動、感覺區精確定位評估具有重要價值,MEG 指導功能區癲癇手術入路設計,與神經導航結合應用于手術,則既可顯示膠質瘤位置,又可反映了癲癲灶和腦功能區域[14]。神經導航系統與 MEG 圖像資料進行融合,通過觀察棒的指引,在實際解剖部位區顯示功能圖像,為避免術后出現語言、記憶、運動、感覺等神經功能障礙提供了重要信息[15-17]。
神經導航系統目前已由單純解剖導航向功能導航方向發展,通過對 CT、MRI、MEG 等多種影像資料融合后的神經導航,可以在術前對腦腫瘤、致癇灶位置及鄰近重要功能區進行準確定位,確定邊界,合理規劃手術切口及入路,避開重要功能結構[18-20]; 術中聯合超聲能夠實時定位示蹤,實現最大程度切除腫瘤及致癇灶,降低術后神經功能障礙的發生率。