引用本文: 李莉, 張蔚然, 蔣小剛, 韓志鋒, 劉超, 劉磊, 王曉明. 血管內皮生長因子受體(KDR)陽性細胞在心肌球樣結構、血管和心肌成形中的作用. 中國胸心血管外科臨床雜志, 2018, 25(4): 333-337. doi: 10.7507/1007-4848.201701025 復制
缺血性心臟病導致的心力衰竭嚴重影響了患者的生存和生活質量,這已成為目前亟待解決的重大醫療課題之一。長期以來,心臟被認為是非再生器官,當發生組織缺血導致大量心肌細胞壞死時,心肌組織只能被缺乏收縮功能的疤痕組織替代[1-2]。有研究表明,心肌細胞在特定條件下可以自我更新,其自我更新和修復的過程與內源性的心臟干細胞(cardiac stem cells,CSCs)有關[3]。這些細胞具有分裂增殖能力并可以分化成成熟心肌細胞[4]。心臟的這種自我更新能力可以補充由于各種原因導致的少量心肌細胞喪失。目前,科學家們正在研究如何激發心臟內源性的修復能力,促進受損心肌的修復和再生。其中利用小分子藥物(如肝細胞生長因子、成纖維細胞生長因子以及類胰島素生長因子 1 等)干預治療被證明沒有特異性,而另一種策略是從心肌組織中分離 CSCs,在體外擴增到一定數量以后,回輸到患者心臟,從而增強心臟修復能力。這種心源性干細胞移植與以往細胞治療不同的是,CSCs 具有和心臟組織很好的兼容性,可以更好地整合到心肌組織[1]。
CSCs 一直被認為具有 c-kit 陽性標記,所以可以被分離和純化,并一度被用于二期臨床研究[5]。但是,c-kit 被認為是骨髓來源細胞的標記蛋白,用遺傳跟蹤的方法顯示,c-kit 陽性細胞并不能分化成心肌細胞,可能并不參與心肌修復過程[6]。以往的研究發現,血管內皮生長因子受體(kinase insert domain containing receptor,KDR)陽性細胞參與中胚層發育[7],體外培養時,形成心肌球樣結構[8]。因此,本文進一步分析 KDR 陽性細胞的成心肌和成血管能力,探討 KDR 陽性細胞作為細胞供體在治療缺血性心臟病中的潛在作用。
1 材料與方法
1.1 實驗動物
24 只約 250 g Wistar 大鼠,由浙江中醫藥大學動物實驗中心提供。
1.2 實驗試劑
小鼠抗肌鈣蛋白T(cardiac troponin T,cTnT)多克隆抗體(Santa Cruz 公司,美國)、兔抗 KDR 多克隆抗體(Santa Cruz 公司,美國)、四甲基異硫氰酸羅丹明(TRITC)及異硫氰酸熒光素(FITC)標志的羊抗兔抗血清(Dako 公司,德國)。
1.3 實驗儀器
Leica 冰凍切片機,Olympus 熒光顯微鏡。
1.4 免疫組化分析
利用 CO2 窒息法處死動物,打開胸腔,取出心臟,清洗后用 OCT 在 –30℃ 速凍成組織包塊,切成 7 μm 厚度的組織切片。1% 多聚甲醛固定后,進行間接免疫熒光染色。
心臟組織切片首先用羊血清封閉 30 min,然后加入一抗(抗 KDR),放入濕盒內,室溫下孵育 2 h,再用磷酸緩沖鹽溶液(PBS)洗去一抗,洗滌 3 次,每次 5 min,后加入熒光二抗,室溫孵育 1 h,PBS 洗去多余的二抗,洗滌 3 次,每次 5 min,4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染細胞核 30 s,洗滌后用 Fluormount 封片,熒光顯微鏡數碼成像。
1.5 心肌球源性細胞(cardiosphere-derived cells,CDCs)的分離和培養
利用 CO2 窒息法將大鼠處死,75% 酒精浸泡 3 min。在無菌的情況下,剪開大鼠腹部,并沿肋骨邊緣將隔膜小心剪開,暴露出胸腔。將心臟取出后,用生理鹽水清洗干凈,用組織剪將組織充分剪碎,再用 PBS 洗去脂肪滴,加入心臟組織 3 倍體積的膠原酶,進行消化,混勻后轉移到 15 ml 的離心管內。37℃ 水浴鍋中消化 30 min(每隔 5 min 取出混勻一次),用 100 目濾網過濾。將濾液離心后棄掉上清液,用基礎培養液(低糖 DMEM 培養液,30% 胎牛血清,2 mmol/L 谷氨酰胺,100 U/ml 青霉素,100 U/ml 鏈霉素,pH 7.2)將細胞重懸,接種到 T25 培養瓶中,并放于 CO2 培養箱中。72 h 后進行觀察及換液,小心棄去培養液中未貼壁細胞,并加入新的培養液。以后每 3 d 換液一次。細胞鋪滿瓶底 70%~80% 時,用 0.25% 胰蛋白酶(含 0.02% EDTA,0.04 ml/cm2)消化后傳代,傳代比例為 1∶3。通過體外連續傳代培養,分析觀察傳代細胞克隆樣生長情況。
1.6 流式細胞儀檢測
取第 3 代細胞,待細胞生長鋪滿培養瓶底 90% 時,用 0.25% 胰蛋白酶消化,并轉移至離心管內,1 500 轉離心 15 min 后,用 PBS 重懸細胞,調整細胞密度為 3.0×106/ml。將 100 μl 細胞懸液分裝于 5 ml 離心管,并于各個樣品管內加入相對應的抗體,分別為 CD29,CD34,CD44,CD45,CD90,CD105(購自美國 Biolegend 公司,1∶100~200 稀釋)的熒光抗體。4℃ 避光孵育 30 min 后,再向每樣品管內添加 2 ml PBS,離心后棄上清液,去除多余的抗體。最后,每樣品管加入 500 μl PBS,將細胞重懸,上機檢測。
1.7 CDCs 的免疫組化檢測
將第 3 代的 CDCs 接種于細胞培養玻片中,3 d 后作免疫組化染色檢測。將培養玻片中的培養液棄去,用 1% 多聚甲醛固定后,再用羊血清封閉 30 min,分別加入一抗(KDR、cTnT)室溫孵育 2 h,然后用 PBS 洗去一抗,洗滌 3 次,每次 5 min,后加入二抗并室溫孵育 1 h,然后用 PBS 洗去二抗,洗滌 3 次,每次 5 min,最后利用 DAPI 染核,洗滌后用 Fluormount 封片,熒光顯微鏡數碼成像。
2 結果
2.1 大鼠心臟組織存在 KDR 陽性細胞
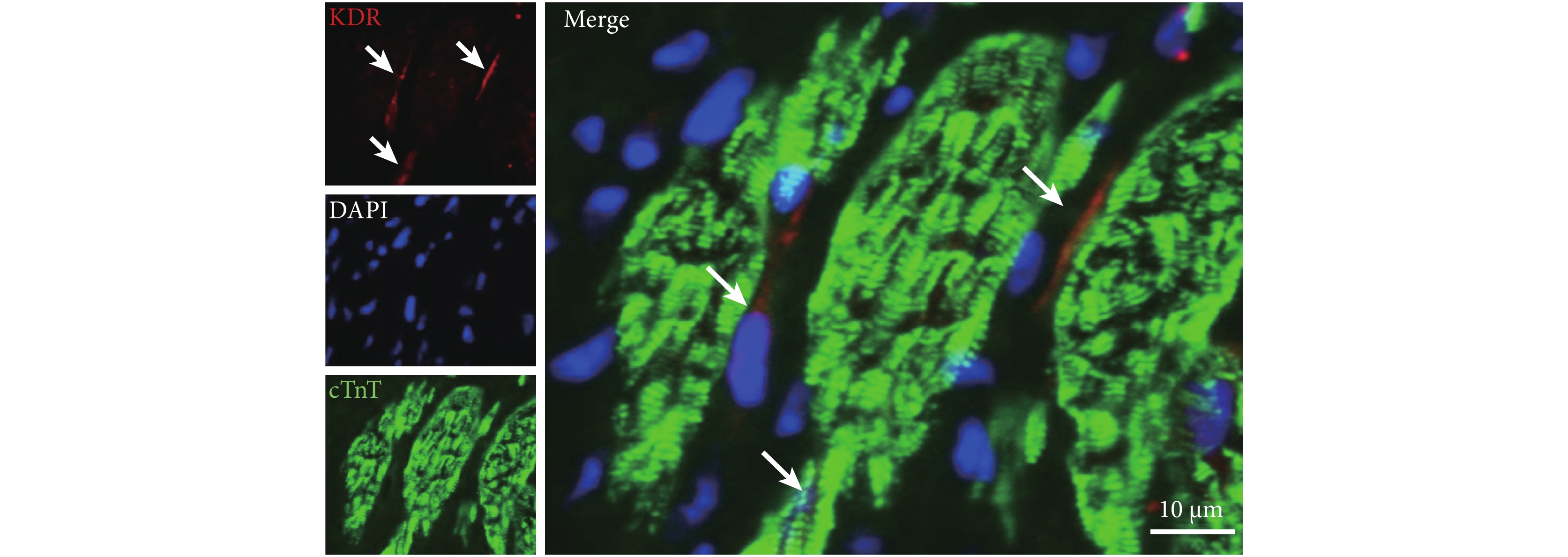
用免疫組化的方法檢測大鼠心臟的冰凍切片,發現心肌組織中部分間質細胞呈 KDR 染色陽性(圖 1),表明成年大鼠心臟中含有 KDR 陽性為特征的 CSCs。與以往報道的圓形的 c-kit 陽性細胞形態不同,KDR 陽性細胞呈紡錘型,且細胞核和細胞漿比例較大,符合間質細胞的形態特征。
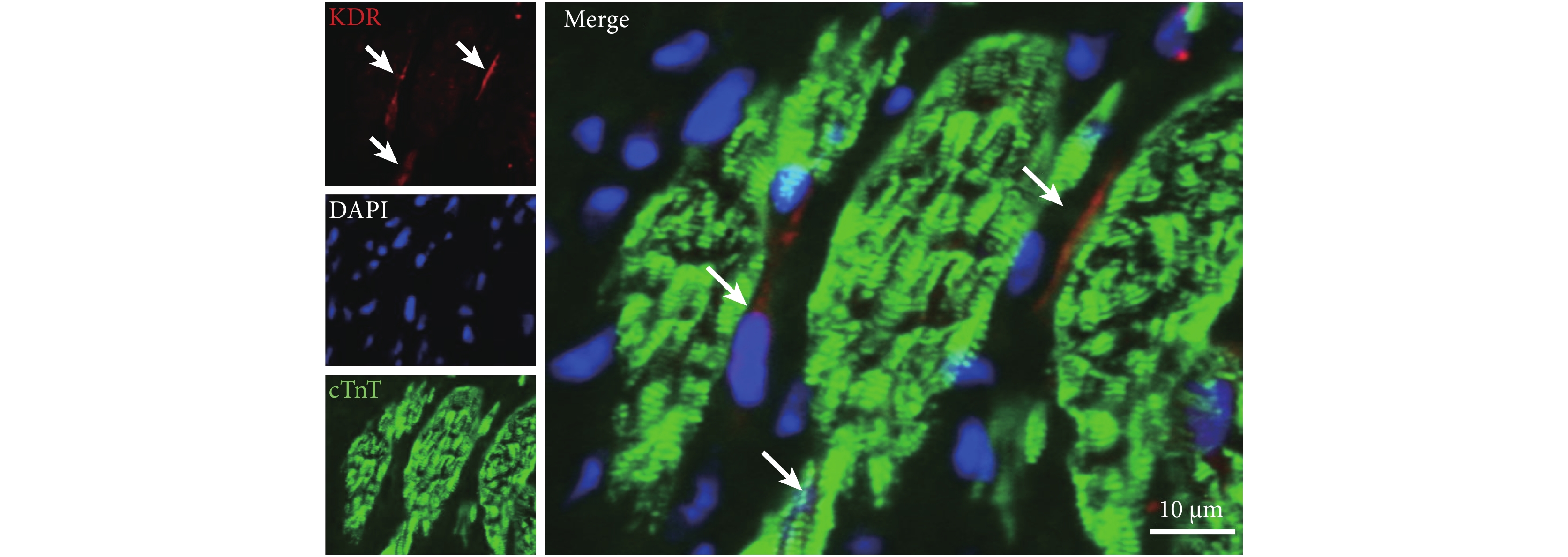 圖1
KDR 陽性細胞存在于心肌細胞間質
圖1
KDR 陽性細胞存在于心肌細胞間質
2.2 流式細胞儀分析
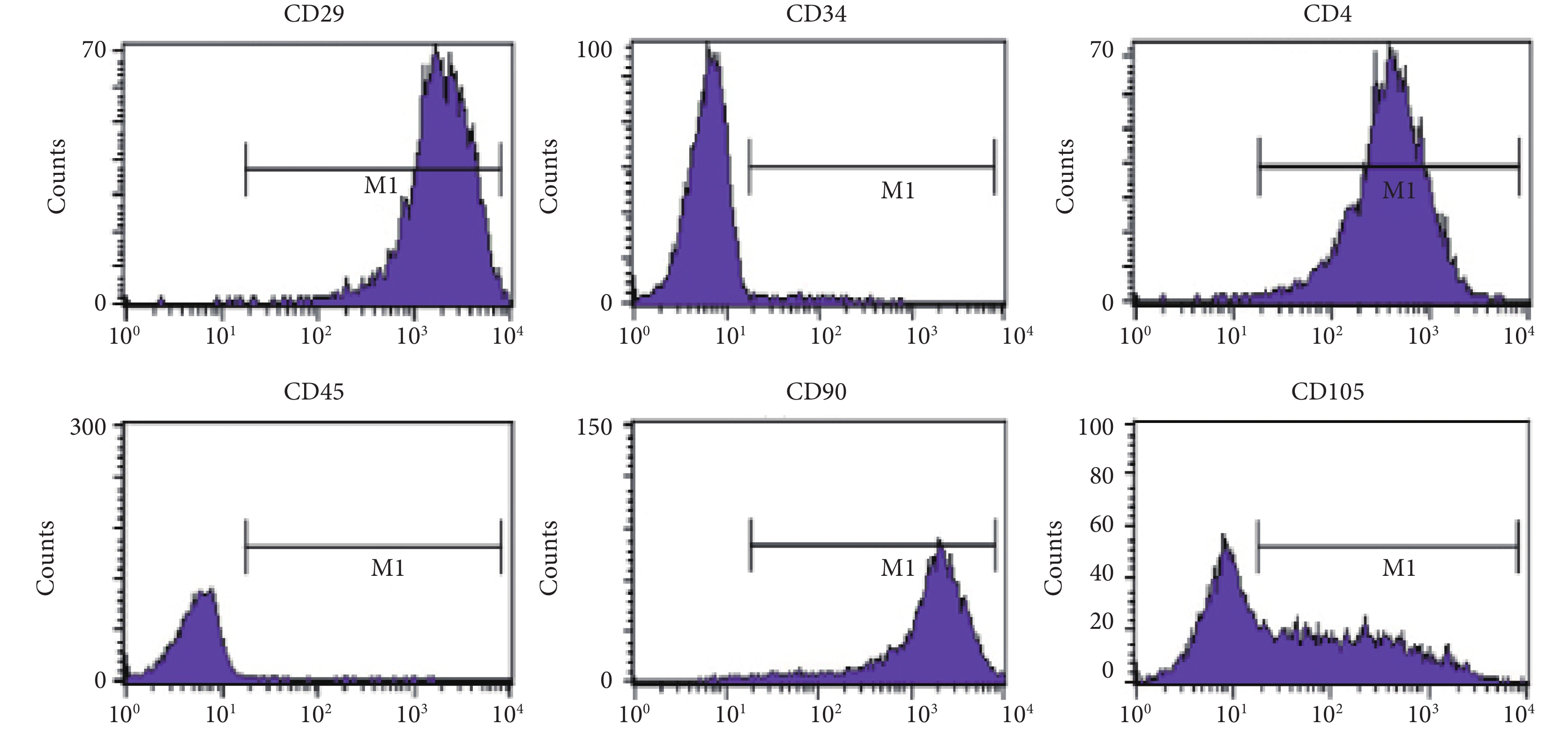
從心肌組織中消化分離了 CDCs,細胞呈間質細胞形態。分離的 CDCs 經體外培養后,用流式細胞儀分析細胞的免疫表型,結果顯示,這些細胞為 CD29、CD44、CD90、CD105 陽性,然而 CD34 和 CD45 呈陰性(圖 2),表明分離培養的的細胞具有間充質干細胞的細胞特征,而不是骨髓來源的細胞。
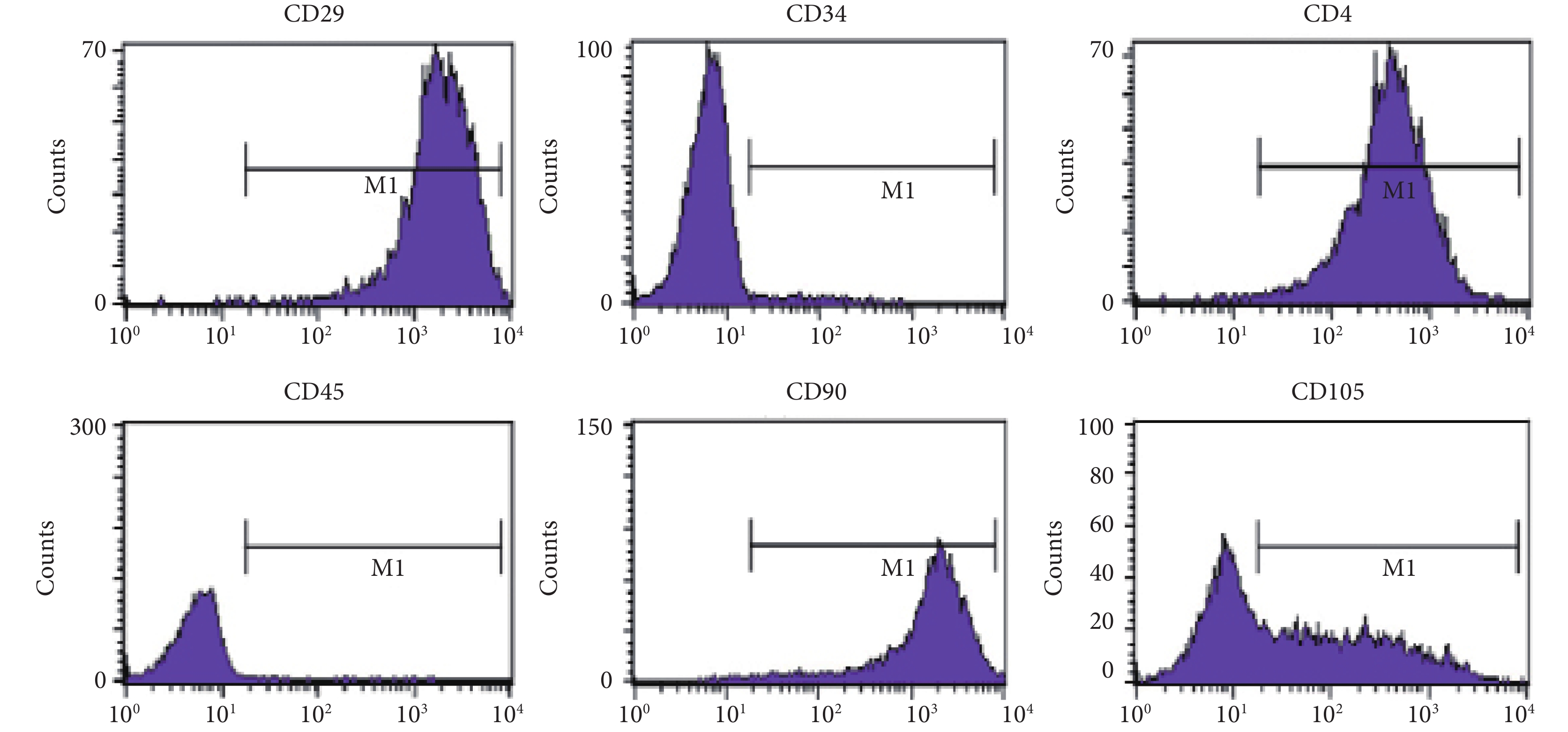 圖2
CDCs 呈 CD29、CD44、CD90、CD105 陽性,CD34、CD45 陰性
圖2
CDCs 呈 CD29、CD44、CD90、CD105 陽性,CD34、CD45 陰性
2.3 免疫組化分析
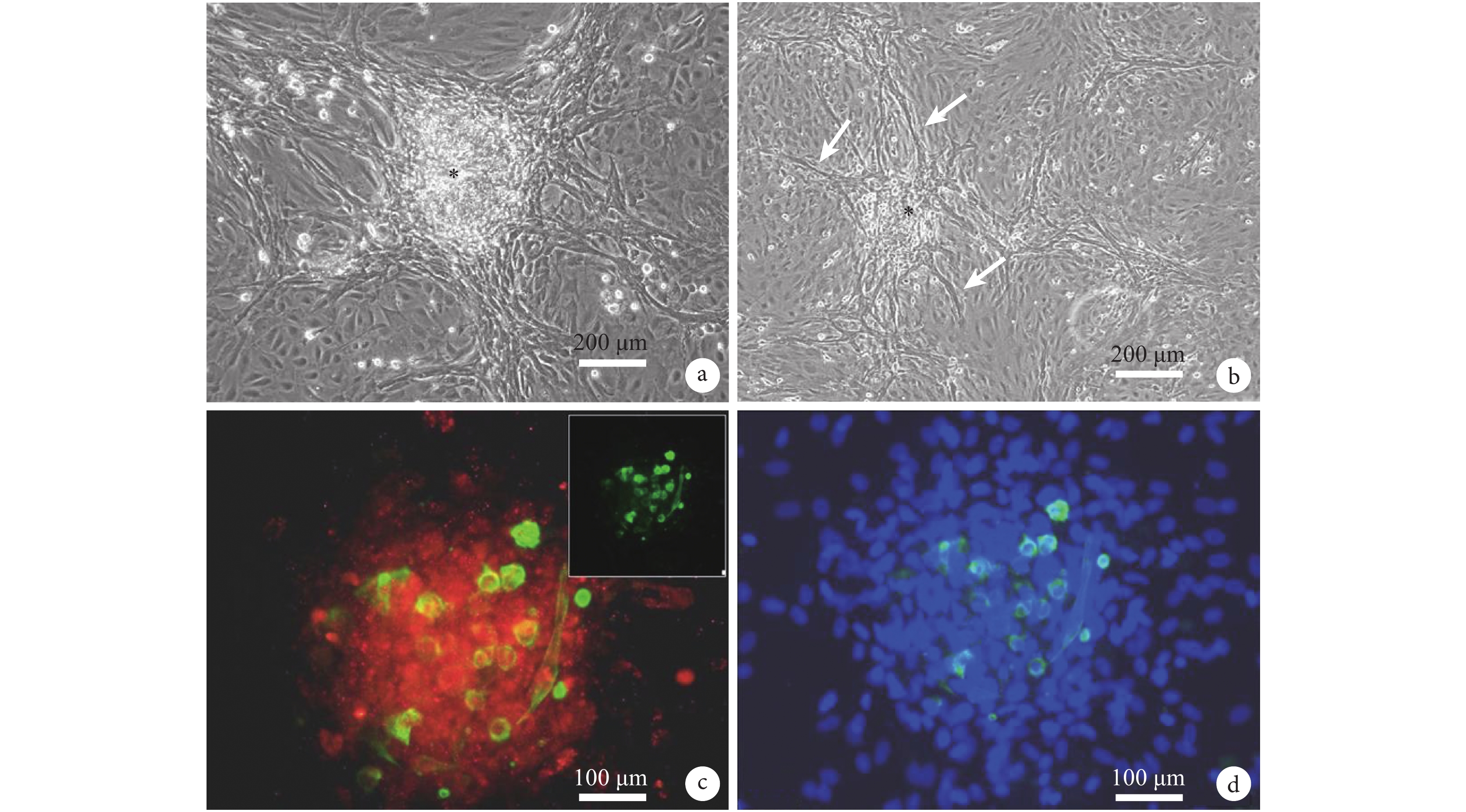
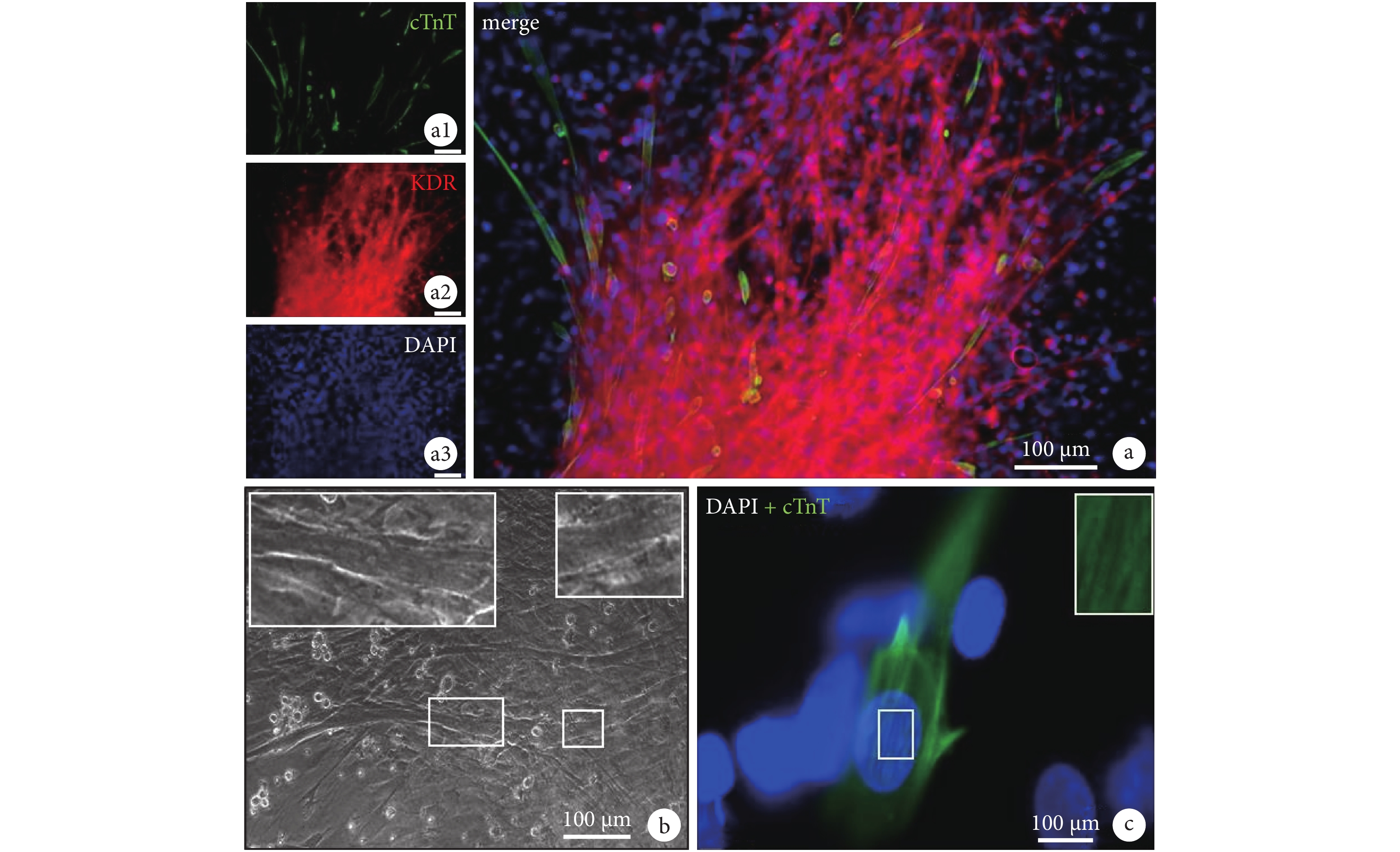
進一步培養的 CDCs,當細胞大于 90% 鋪滿時,部分區域細胞呈克隆樣生長并形成球樣結構(圖 3),從球樣結構中,可見血管樣結構向外生長(圖 3b)。免疫組化顯示,細胞團的主要細胞為 KDR 陽性細胞,同時細胞團中存在大量的 cTnT 陽性細胞,部分 cTnT 陽性細胞呈圓形,直徑約 10 μm ,而部分則伸展成巨大細胞,有的直徑可達 100 μm(圖 3c 、圖 3d)。表明 KDR 陽性細胞可以形成心肌球樣結構,并具有心肌細胞分化潛能。
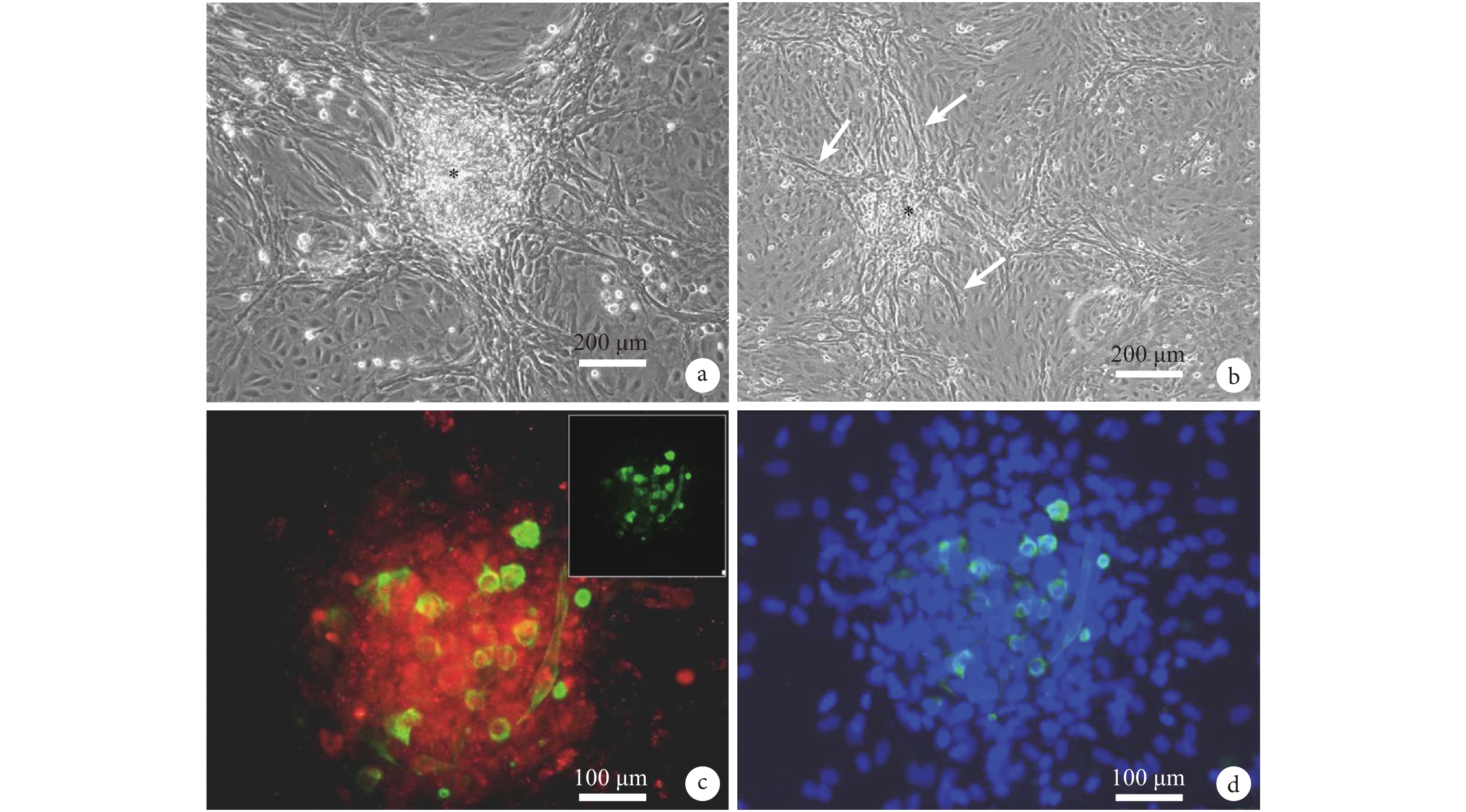 圖3
培養的 CDCs 呈克隆樣生長并形成球樣結構(a 和 b 中星號所示),并可見血管樣結構向外生長(b 中箭頭所示);免疫組化結果顯示,細胞團的主要細胞組分為 KDR 陽性細胞,同時細胞團中存在大量的 cTnT 陽性細胞(c 和 d,藍色為 DAPI 細胞核染色)
圖3
培養的 CDCs 呈克隆樣生長并形成球樣結構(a 和 b 中星號所示),并可見血管樣結構向外生長(b 中箭頭所示);免疫組化結果顯示,細胞團的主要細胞組分為 KDR 陽性細胞,同時細胞團中存在大量的 cTnT 陽性細胞(c 和 d,藍色為 DAPI 細胞核染色)
進一步分析表明,KDR 細胞從細胞球向外遷移,并形成中空型血管樣結構(圖 4a)。這些血管樣結構中,主要是 KDR 陽性細胞,提示 KDR 陽性細胞參與血管再生過程。同時,細胞球中的 cTnT 陽性細胞進一步發育成熟,并形成肌小節結構(圖 4b),并在離體培養條件下,產生自在搏動(圖 4c)。表明 KDR 陽性的 CDCs 既有血管再生作用,也有較強的分化為成熟心肌細胞的潛能。
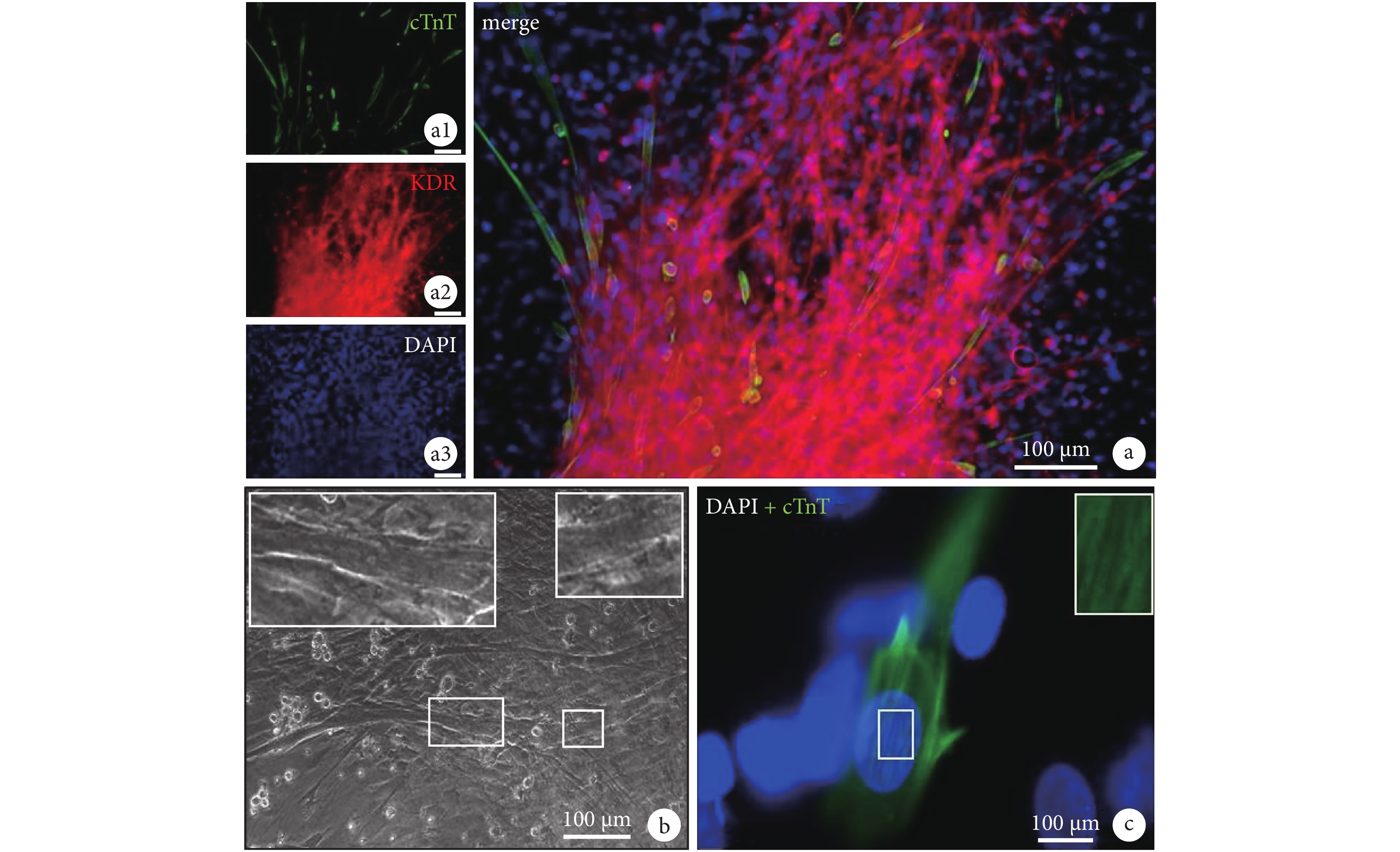 圖4
KDR 陽性細胞從細胞球向外遷移,并形成中空型血管樣結構(a);同時,細胞球中的 cTnT 陽性細胞進一步發育成熟,形成肌小節(b),并產生自在搏動(c)
圖4
KDR 陽性細胞從細胞球向外遷移,并形成中空型血管樣結構(a);同時,細胞球中的 cTnT 陽性細胞進一步發育成熟,形成肌小節(b),并產生自在搏動(c)
3 討論
近 10 年來,干細胞定向分化為心肌細胞的技術日益成熟,通過心肌成形術修復受損心肌成為治療缺血性心臟病最有前景的治療方法之一[1]。但是,細胞供體的選擇很大程度上會影響到治療效果。之前開展研究的胚胎干細胞和最近發現的誘導的多能干細胞進一步應用于臨床受到了多方面限制,如倫理學問題、分化為畸胎瘤的風險、免疫排斥反應等。目前正在實施干細胞治療缺血性心臟病的臨床試驗,主要采用自體的骨髓干細胞和脂肪干細胞[9]。多中心的 Meta 分析表明,細胞治療對改善心功能效果微弱,主要原因為非心源性成體干細胞在心臟中成活率低[10]。因此,選擇合適的供體細胞對細胞治療的臨床療效至關重要。
CDCs 細胞可能是心血管系統在胚胎發育過程中第二心區殘留的特殊細胞群,是一種特殊的 CSCs。心臟第二心區的細胞主要來源于流出道附近,進一步遷移至室間隔和心室表層,發育成心外膜、冠狀動脈系統和部分心外膜下心肌[11]。當心臟發育成熟以后,這些細胞可以繼續留在成體心臟的細胞間質中。當心肌受損時,CDCs 可能參與了心肌損傷后的自我更新和修復過程[3]。因此,CDCs 代表了心臟組織的內源性修復和再生能力。通過體外擴增,可以放大 CSCs 的心臟修復能力,補充缺失的心肌細胞,改善心功能[1]。
然而,由于 CSCs 沒有特異的細胞表型,很大程度上制約了 CSCs 的純化和進一步的臨床應用。我們用流式細胞儀分析 CDCs 的免疫表型,發現 CDCs 與機體的其他組織的間充質干細胞非常類似,都是 CD90 和 CD105 陽性細胞群。2011 年,Chong 等[12]的實驗進一步證明了 CDCs 是心臟固有的干細胞,可以形成成纖維細胞樣克隆樣結構,并具有多向分化潛能。以往的研究一直認為 CSCs 主要是 c-kit 陽性細胞[13]。我們的實驗結果表明,從心臟組織分離的 CDCs 含有 KDR 陽性細胞,在體外培養條件下,呈克隆樣生長,并進一步形成心肌球樣結構。根據這一生物學特征,KDR 可以作為細胞表面標識蛋白,分離和純化 CSCs,為干細胞治療缺血性心臟病提供有效的細胞供體。
KDR 又稱 flk-1,是血管內皮生長因子(VEGF)的二型受體,主要表達于血管內皮細胞和內皮細胞的前體細胞[14-15]。但 KDR 陽性細胞也參與了中胚層細胞的發育過程,同時,也可以分化成成熟的心肌細胞[7]。我們的研究表明,分離的 CDCs 中的 KDR 陽性細胞形成細胞聚集,可以進一步形成心肌球樣細胞結構。一旦形成以后,KDR 陽性細胞可以分化形成兩類的心血管細胞:一是從細胞聚集中向外遷移,并形成類似血管組織樣的管狀形態;一是部分細胞分化成心肌前體細胞(以表達 cTnT 為特征),并發育成成熟的心肌細胞。KDR 陽性細胞的雙重生物特征,可以很大程度上滿足供體細胞參與心肌修復的必要條件,即在缺血壞死的心肌組織中誘導血管再生和心肌再生。因此,KDR 陽性細胞是一種治療缺血性心肌病的潛在細胞供體,其能否應用于臨床及療效如何需要進一步研究。
缺血性心臟病導致的心力衰竭嚴重影響了患者的生存和生活質量,這已成為目前亟待解決的重大醫療課題之一。長期以來,心臟被認為是非再生器官,當發生組織缺血導致大量心肌細胞壞死時,心肌組織只能被缺乏收縮功能的疤痕組織替代[1-2]。有研究表明,心肌細胞在特定條件下可以自我更新,其自我更新和修復的過程與內源性的心臟干細胞(cardiac stem cells,CSCs)有關[3]。這些細胞具有分裂增殖能力并可以分化成成熟心肌細胞[4]。心臟的這種自我更新能力可以補充由于各種原因導致的少量心肌細胞喪失。目前,科學家們正在研究如何激發心臟內源性的修復能力,促進受損心肌的修復和再生。其中利用小分子藥物(如肝細胞生長因子、成纖維細胞生長因子以及類胰島素生長因子 1 等)干預治療被證明沒有特異性,而另一種策略是從心肌組織中分離 CSCs,在體外擴增到一定數量以后,回輸到患者心臟,從而增強心臟修復能力。這種心源性干細胞移植與以往細胞治療不同的是,CSCs 具有和心臟組織很好的兼容性,可以更好地整合到心肌組織[1]。
CSCs 一直被認為具有 c-kit 陽性標記,所以可以被分離和純化,并一度被用于二期臨床研究[5]。但是,c-kit 被認為是骨髓來源細胞的標記蛋白,用遺傳跟蹤的方法顯示,c-kit 陽性細胞并不能分化成心肌細胞,可能并不參與心肌修復過程[6]。以往的研究發現,血管內皮生長因子受體(kinase insert domain containing receptor,KDR)陽性細胞參與中胚層發育[7],體外培養時,形成心肌球樣結構[8]。因此,本文進一步分析 KDR 陽性細胞的成心肌和成血管能力,探討 KDR 陽性細胞作為細胞供體在治療缺血性心臟病中的潛在作用。
1 材料與方法
1.1 實驗動物
24 只約 250 g Wistar 大鼠,由浙江中醫藥大學動物實驗中心提供。
1.2 實驗試劑
小鼠抗肌鈣蛋白T(cardiac troponin T,cTnT)多克隆抗體(Santa Cruz 公司,美國)、兔抗 KDR 多克隆抗體(Santa Cruz 公司,美國)、四甲基異硫氰酸羅丹明(TRITC)及異硫氰酸熒光素(FITC)標志的羊抗兔抗血清(Dako 公司,德國)。
1.3 實驗儀器
Leica 冰凍切片機,Olympus 熒光顯微鏡。
1.4 免疫組化分析
利用 CO2 窒息法處死動物,打開胸腔,取出心臟,清洗后用 OCT 在 –30℃ 速凍成組織包塊,切成 7 μm 厚度的組織切片。1% 多聚甲醛固定后,進行間接免疫熒光染色。
心臟組織切片首先用羊血清封閉 30 min,然后加入一抗(抗 KDR),放入濕盒內,室溫下孵育 2 h,再用磷酸緩沖鹽溶液(PBS)洗去一抗,洗滌 3 次,每次 5 min,后加入熒光二抗,室溫孵育 1 h,PBS 洗去多余的二抗,洗滌 3 次,每次 5 min,4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染細胞核 30 s,洗滌后用 Fluormount 封片,熒光顯微鏡數碼成像。
1.5 心肌球源性細胞(cardiosphere-derived cells,CDCs)的分離和培養
利用 CO2 窒息法將大鼠處死,75% 酒精浸泡 3 min。在無菌的情況下,剪開大鼠腹部,并沿肋骨邊緣將隔膜小心剪開,暴露出胸腔。將心臟取出后,用生理鹽水清洗干凈,用組織剪將組織充分剪碎,再用 PBS 洗去脂肪滴,加入心臟組織 3 倍體積的膠原酶,進行消化,混勻后轉移到 15 ml 的離心管內。37℃ 水浴鍋中消化 30 min(每隔 5 min 取出混勻一次),用 100 目濾網過濾。將濾液離心后棄掉上清液,用基礎培養液(低糖 DMEM 培養液,30% 胎牛血清,2 mmol/L 谷氨酰胺,100 U/ml 青霉素,100 U/ml 鏈霉素,pH 7.2)將細胞重懸,接種到 T25 培養瓶中,并放于 CO2 培養箱中。72 h 后進行觀察及換液,小心棄去培養液中未貼壁細胞,并加入新的培養液。以后每 3 d 換液一次。細胞鋪滿瓶底 70%~80% 時,用 0.25% 胰蛋白酶(含 0.02% EDTA,0.04 ml/cm2)消化后傳代,傳代比例為 1∶3。通過體外連續傳代培養,分析觀察傳代細胞克隆樣生長情況。
1.6 流式細胞儀檢測
取第 3 代細胞,待細胞生長鋪滿培養瓶底 90% 時,用 0.25% 胰蛋白酶消化,并轉移至離心管內,1 500 轉離心 15 min 后,用 PBS 重懸細胞,調整細胞密度為 3.0×106/ml。將 100 μl 細胞懸液分裝于 5 ml 離心管,并于各個樣品管內加入相對應的抗體,分別為 CD29,CD34,CD44,CD45,CD90,CD105(購自美國 Biolegend 公司,1∶100~200 稀釋)的熒光抗體。4℃ 避光孵育 30 min 后,再向每樣品管內添加 2 ml PBS,離心后棄上清液,去除多余的抗體。最后,每樣品管加入 500 μl PBS,將細胞重懸,上機檢測。
1.7 CDCs 的免疫組化檢測
將第 3 代的 CDCs 接種于細胞培養玻片中,3 d 后作免疫組化染色檢測。將培養玻片中的培養液棄去,用 1% 多聚甲醛固定后,再用羊血清封閉 30 min,分別加入一抗(KDR、cTnT)室溫孵育 2 h,然后用 PBS 洗去一抗,洗滌 3 次,每次 5 min,后加入二抗并室溫孵育 1 h,然后用 PBS 洗去二抗,洗滌 3 次,每次 5 min,最后利用 DAPI 染核,洗滌后用 Fluormount 封片,熒光顯微鏡數碼成像。
2 結果
2.1 大鼠心臟組織存在 KDR 陽性細胞
用免疫組化的方法檢測大鼠心臟的冰凍切片,發現心肌組織中部分間質細胞呈 KDR 染色陽性(圖 1),表明成年大鼠心臟中含有 KDR 陽性為特征的 CSCs。與以往報道的圓形的 c-kit 陽性細胞形態不同,KDR 陽性細胞呈紡錘型,且細胞核和細胞漿比例較大,符合間質細胞的形態特征。
 圖1
KDR 陽性細胞存在于心肌細胞間質
圖1
KDR 陽性細胞存在于心肌細胞間質
2.2 流式細胞儀分析
從心肌組織中消化分離了 CDCs,細胞呈間質細胞形態。分離的 CDCs 經體外培養后,用流式細胞儀分析細胞的免疫表型,結果顯示,這些細胞為 CD29、CD44、CD90、CD105 陽性,然而 CD34 和 CD45 呈陰性(圖 2),表明分離培養的的細胞具有間充質干細胞的細胞特征,而不是骨髓來源的細胞。
 圖2
CDCs 呈 CD29、CD44、CD90、CD105 陽性,CD34、CD45 陰性
圖2
CDCs 呈 CD29、CD44、CD90、CD105 陽性,CD34、CD45 陰性
2.3 免疫組化分析
進一步培養的 CDCs,當細胞大于 90% 鋪滿時,部分區域細胞呈克隆樣生長并形成球樣結構(圖 3),從球樣結構中,可見血管樣結構向外生長(圖 3b)。免疫組化顯示,細胞團的主要細胞為 KDR 陽性細胞,同時細胞團中存在大量的 cTnT 陽性細胞,部分 cTnT 陽性細胞呈圓形,直徑約 10 μm ,而部分則伸展成巨大細胞,有的直徑可達 100 μm(圖 3c 、圖 3d)。表明 KDR 陽性細胞可以形成心肌球樣結構,并具有心肌細胞分化潛能。
 圖3
培養的 CDCs 呈克隆樣生長并形成球樣結構(a 和 b 中星號所示),并可見血管樣結構向外生長(b 中箭頭所示);免疫組化結果顯示,細胞團的主要細胞組分為 KDR 陽性細胞,同時細胞團中存在大量的 cTnT 陽性細胞(c 和 d,藍色為 DAPI 細胞核染色)
圖3
培養的 CDCs 呈克隆樣生長并形成球樣結構(a 和 b 中星號所示),并可見血管樣結構向外生長(b 中箭頭所示);免疫組化結果顯示,細胞團的主要細胞組分為 KDR 陽性細胞,同時細胞團中存在大量的 cTnT 陽性細胞(c 和 d,藍色為 DAPI 細胞核染色)
進一步分析表明,KDR 細胞從細胞球向外遷移,并形成中空型血管樣結構(圖 4a)。這些血管樣結構中,主要是 KDR 陽性細胞,提示 KDR 陽性細胞參與血管再生過程。同時,細胞球中的 cTnT 陽性細胞進一步發育成熟,并形成肌小節結構(圖 4b),并在離體培養條件下,產生自在搏動(圖 4c)。表明 KDR 陽性的 CDCs 既有血管再生作用,也有較強的分化為成熟心肌細胞的潛能。
 圖4
KDR 陽性細胞從細胞球向外遷移,并形成中空型血管樣結構(a);同時,細胞球中的 cTnT 陽性細胞進一步發育成熟,形成肌小節(b),并產生自在搏動(c)
圖4
KDR 陽性細胞從細胞球向外遷移,并形成中空型血管樣結構(a);同時,細胞球中的 cTnT 陽性細胞進一步發育成熟,形成肌小節(b),并產生自在搏動(c)
3 討論
近 10 年來,干細胞定向分化為心肌細胞的技術日益成熟,通過心肌成形術修復受損心肌成為治療缺血性心臟病最有前景的治療方法之一[1]。但是,細胞供體的選擇很大程度上會影響到治療效果。之前開展研究的胚胎干細胞和最近發現的誘導的多能干細胞進一步應用于臨床受到了多方面限制,如倫理學問題、分化為畸胎瘤的風險、免疫排斥反應等。目前正在實施干細胞治療缺血性心臟病的臨床試驗,主要采用自體的骨髓干細胞和脂肪干細胞[9]。多中心的 Meta 分析表明,細胞治療對改善心功能效果微弱,主要原因為非心源性成體干細胞在心臟中成活率低[10]。因此,選擇合適的供體細胞對細胞治療的臨床療效至關重要。
CDCs 細胞可能是心血管系統在胚胎發育過程中第二心區殘留的特殊細胞群,是一種特殊的 CSCs。心臟第二心區的細胞主要來源于流出道附近,進一步遷移至室間隔和心室表層,發育成心外膜、冠狀動脈系統和部分心外膜下心肌[11]。當心臟發育成熟以后,這些細胞可以繼續留在成體心臟的細胞間質中。當心肌受損時,CDCs 可能參與了心肌損傷后的自我更新和修復過程[3]。因此,CDCs 代表了心臟組織的內源性修復和再生能力。通過體外擴增,可以放大 CSCs 的心臟修復能力,補充缺失的心肌細胞,改善心功能[1]。
然而,由于 CSCs 沒有特異的細胞表型,很大程度上制約了 CSCs 的純化和進一步的臨床應用。我們用流式細胞儀分析 CDCs 的免疫表型,發現 CDCs 與機體的其他組織的間充質干細胞非常類似,都是 CD90 和 CD105 陽性細胞群。2011 年,Chong 等[12]的實驗進一步證明了 CDCs 是心臟固有的干細胞,可以形成成纖維細胞樣克隆樣結構,并具有多向分化潛能。以往的研究一直認為 CSCs 主要是 c-kit 陽性細胞[13]。我們的實驗結果表明,從心臟組織分離的 CDCs 含有 KDR 陽性細胞,在體外培養條件下,呈克隆樣生長,并進一步形成心肌球樣結構。根據這一生物學特征,KDR 可以作為細胞表面標識蛋白,分離和純化 CSCs,為干細胞治療缺血性心臟病提供有效的細胞供體。
KDR 又稱 flk-1,是血管內皮生長因子(VEGF)的二型受體,主要表達于血管內皮細胞和內皮細胞的前體細胞[14-15]。但 KDR 陽性細胞也參與了中胚層細胞的發育過程,同時,也可以分化成成熟的心肌細胞[7]。我們的研究表明,分離的 CDCs 中的 KDR 陽性細胞形成細胞聚集,可以進一步形成心肌球樣細胞結構。一旦形成以后,KDR 陽性細胞可以分化形成兩類的心血管細胞:一是從細胞聚集中向外遷移,并形成類似血管組織樣的管狀形態;一是部分細胞分化成心肌前體細胞(以表達 cTnT 為特征),并發育成成熟的心肌細胞。KDR 陽性細胞的雙重生物特征,可以很大程度上滿足供體細胞參與心肌修復的必要條件,即在缺血壞死的心肌組織中誘導血管再生和心肌再生。因此,KDR 陽性細胞是一種治療缺血性心肌病的潛在細胞供體,其能否應用于臨床及療效如何需要進一步研究。