引用本文: 李靜靜, 王稚英. 人牙骨移植材料對小鼠單核巨噬細胞RAW264.7 增殖分化的影響. 中國修復重建外科雜志, 2018, 32(10): 1332-1339. doi: 10.7507/1002-1892.201803034 復制
任何一種生物材料應用于臨床,不僅需要具備與機體組織相匹配的理化特性和生物力學性能,還應首先具備使用安全性和良好的生物相容性,這是生物材料獲準臨床使用的前提[1]。近年來,骨移植材料在口腔種植手術中對于修復骨量不足的應用越來越受到重視,骨替代材料的研究和新型材料的研發,成為口腔種植外科和修復重建外科領域的研究熱點。有研究表明,人牙齒硬組織主要成分是高純度的羥基磷灰石,具有與人骨相似的鈣磷比和孔隙結構,是一種潛在的理想骨缺損修復材料[2-3]。王媛等[4]研究證實牙骨移植材料在大鼠體內可以達到良好的骨修復效果,但對于人牙骨移植材料這種新型材料體外的安全性和生物相容性研究相對少見。為探討人牙骨移植材料體外生物相容性,本研究建立了以小鼠單核巨噬細胞為靶細胞的模型,制作人牙骨移植材料,以臨床常見的 OSTEONⅡ人工骨植入物進行對比,研究小鼠單核巨噬細胞在人牙骨移植材料和 OSTEONⅡ人工骨植入物上的增殖與分化活性,為人牙骨移植材料的進一步開發和臨床應用提供實驗依據。
1 材料與方法
1.1 實驗細胞與主要試劑、儀器
小鼠單核巨噬細胞 RAW264.7,由中國科學院典型培養物保藏委員會細胞庫提供。OSTEONⅡ人工骨植入物[登騰(北京)器械商貿有限公司,批號 17F22-02,型號 DT7G0510050]。DMEM 培養基(HyClone 公司,美國);青鏈霉素雙抗(GIBCO 公司,美國);FBS(杭州天杭生物科技有限公司);MTT 試劑盒(上海碧云天生物技術有限公司);錐蟲藍、DMSO(北京索萊寶科技有限公司);碘化丙啶(propidium iodide,PI)染色劑(上海翊圣生物科技有限公司);TNF-α ELISA 試劑盒、IL-6 ELISA 試劑盒(北京誠林生物科技有限公司);ToothOsteoPlant Graft Process Kit(COSMO 公司,韓國)。VacuaSonic 真空超聲波牙齒脫鈣加速器(COSMO 公司,韓國);單光子共聚焦顯微鏡(Leica 公司,德國);倒置相差顯微鏡(Olympus 公司,日本);多功能酶標儀(TECAN 公司,瑞士);血球計數板(MARIENFELD 公司,德國)。
1.2 材料制備方法
1.2.1 人牙骨移植材料的制備
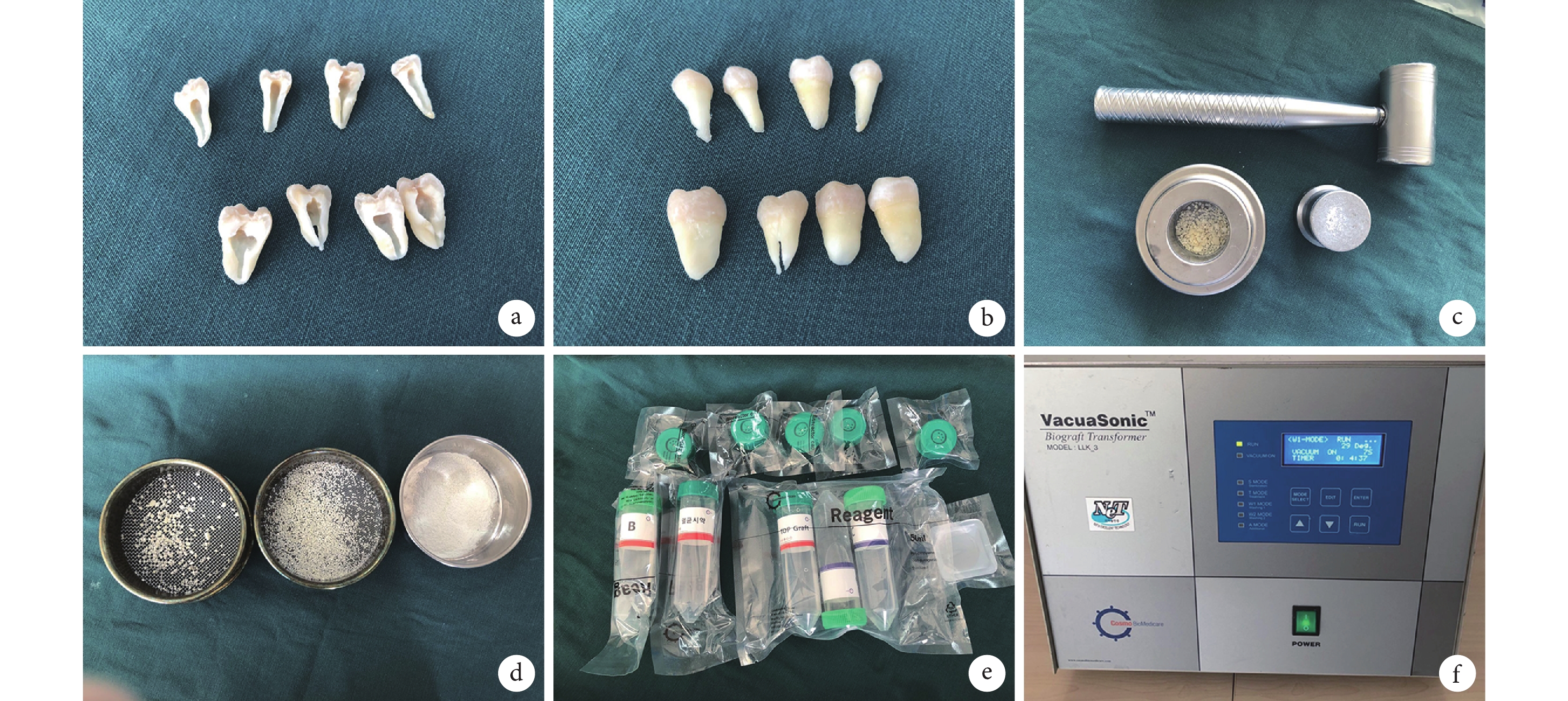
收集錦州醫科大學附屬第二醫院口腔外科及種植科近 1 周內拔除的新鮮離體牙,主要為第 3 磨牙、正畸拔除牙、牙周病晚期無法保留的活髓牙以及外傷無法修復的牙。將收集的離體牙去除軟組織、齲壞組織及色素沉著,專用器械將干燥后的人離體牙加工成約為 1 mm 大小的顆粒狀,按照 ToothOsteoPlant Graft Process Kit 試劑盒說明書,通過 VacuaSonic 真空超聲波牙齒脫鈣加速器處理,得到人牙骨移植材料,4℃ 封存備用。見圖 1。
1.2.2 OSTEONⅡ人工骨植入物
該材料為無菌密封,注意無菌操作,直接用于實驗。
1.2.3 未處理牙粉的制備
按人牙骨移植材料制備的納入標準以及制備方法,將收集的新鮮離體牙去除軟組織后,制備成約 1 mm 大小的顆粒,不經試劑處理,直接用含有 500 U/mL 青鏈霉素雙抗的三蒸水浸泡 10 min,用三蒸水反復沖洗,冷凍干燥,4℃ 保存備用。
1.3 觀測指標
1.3.1 掃描電鏡觀察材料形貌
將制備的人牙骨移植材料、OSTEONⅡ人工骨植入物、未處理牙粉冷凍干燥,噴金,掃描電鏡觀察各材料形貌。
1.3.2 人牙骨移植材料與細胞共培養單光子共聚焦顯微鏡觀察
取對數生長期小鼠單核巨噬細胞 RAW264.7,在含有細胞爬片的 6 孔板中每孔接種 1×106 個細胞,加入 1 500 mg/mL 人牙骨移植材料共同培養 24 h 后,PBS 沖洗,多聚甲醛固定,PI 染色,1 h 內單光子共聚焦顯微鏡觀察。
1.3.3 材料浸提液制備及分組
按照 ISO 10993-12 標準制備各材料浸提液。根據浸提液中的不同成分分為 4 組:A 組為含 10%FBS 的 DMEM 培養液,B 組為人牙骨移植材料,C 組為 OSTEONⅡ人工骨植入物,D 組為未處理牙粉。用于以下觀測。
1.3.4 細胞形態學觀察法定性檢測細胞毒性
取對數生長期小鼠單核巨噬細胞 RAW264.7,按 2×104 個/mL 密度接種于 6 孔板中,每孔 2 mL。貼壁后,分別采用 4 組浸提液培養,7 d 后倒置顯微鏡觀察。隨機選取視野進行拍照,每組取 3 張圖片觀察細胞生長狀況及形態變化,按《GB/T16886.5-2003 醫療器械生物學評價第 5 部分:體外細胞毒性試驗》細胞毒性反應分級標準判定,以評價材料對細胞生長的影響[5]。見表 1。陰性對照組的反應不大于 1 級,陽性對照組至少為 3 級反應。
1.3.5 MTT 檢測細胞增殖分化及細胞毒性
取對數生長期小鼠單核巨噬細胞 RAW264.7,按 2×104個/mL 密度接種于 96 孔板中,每孔 100 μL;24 h 后分別用 4 組浸提液培養,每組設 10 個平行孔。于培養 1、3、5、7 d 時,加入 20 μL MTT(5 mg/mL)孵育 4 h,DMSO 震蕩溶解,酶標儀檢測 492 nm 處的吸光度(A)值。按以下公式計算細胞相對增殖率(relative growth rate,RGR)評價細胞毒性:RGR=(實驗組 A 值/A 組 A 值)×100%。實驗重復 3 次,取均值。按以下標準評價細胞毒性:0 級,RGR≥100%;1 級,RGR 75%~100%;2 級,RGR 50%~75%;3 級,RGR 25%~50%;4 級,RGR 1%~25%;5 級,RGR 為 0。細胞毒性為 0~1 級說明材料合格,3~5 級為不合格,2 級反應結合細胞形態綜合評價。
1.3.6 錐蟲藍染色檢測細胞活力
取對數生長期小鼠單核巨噬細胞 RAW264.7,按 2×104個/mL 密度接種于 24 孔板中,每孔 0.5 mL。貼壁后,分別用 4 組浸提液培養,每組設 3 個平行孔。于培養 1、2、3、4、5、6 d 時每組各取細胞懸液 40 μL,加 0.4% 錐蟲藍 10 μL,3 min 內用血球計數儀計數,倒置顯微鏡下觀察,死細胞被染成藍色,活細胞則拒染,透明不著色。計數各組活細胞并繪制細胞生長曲線。
1.3.7 ELISA 檢測炎性因子分泌
取對數生長期小鼠單核巨噬細胞 RAW264.7,按 2×104個/mL 密度接種于 24 孔板中,每孔 0.5 mL,貼壁后,分別用 4 組浸提液培養,每組設 3 個平行孔。于培養 1、3、5 d 分別收集各組細胞上清,按 ELISA 試劑盒說明書方法檢測炎性因子 TNF-α和 IL-6 的表達。
1.4 統計學方法
采用 SPSS17.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準 α=0.05。
2 結果
2.1 掃描電鏡觀察材料形貌
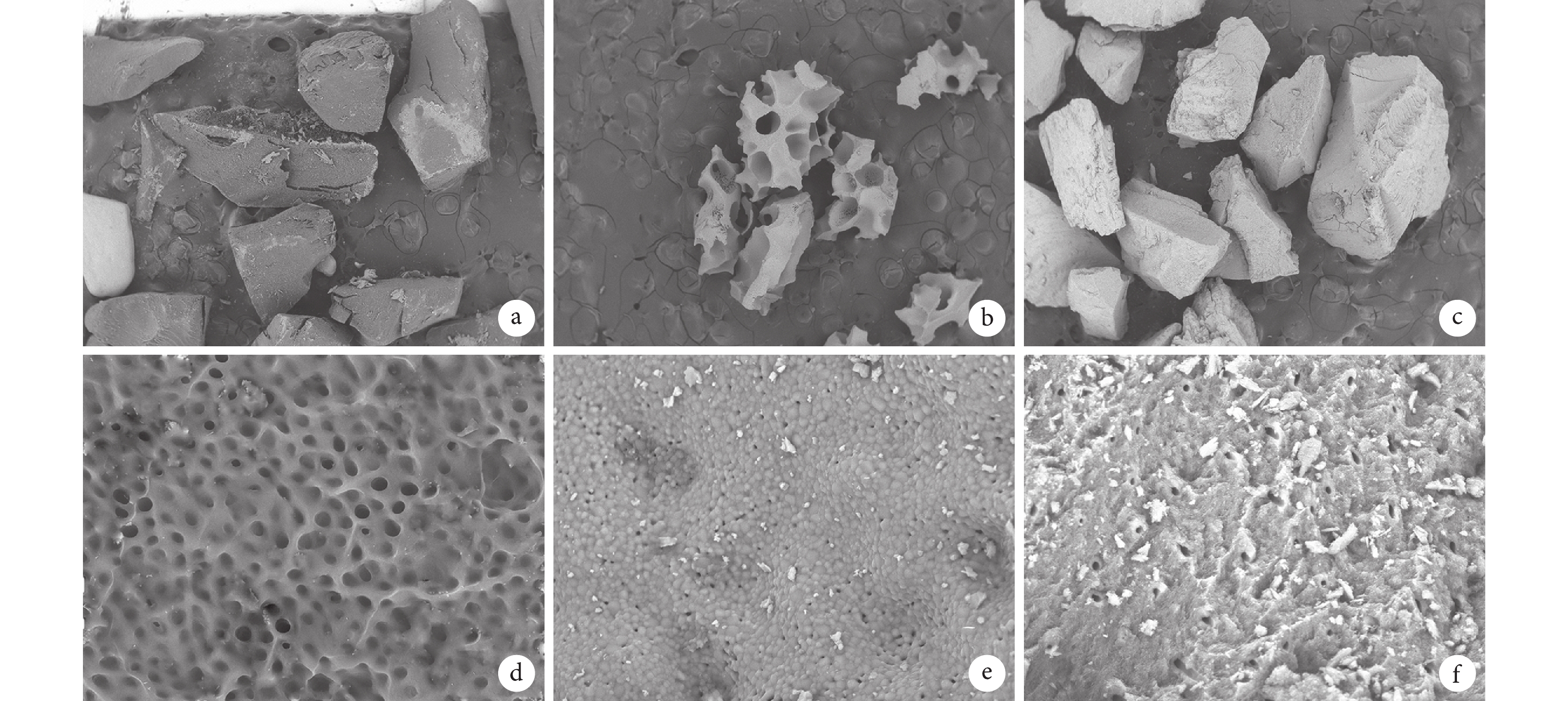
與未處理牙粉比較,人牙骨移植材料和 OSTE-ONⅡ人工骨植入物表面都具有均勻的孔狀結構,在高倍鏡下人牙骨移植材料能觀察到致密多孔結構,OSTEONⅡ人工骨植入物表面更為疏松;在低倍鏡下觀察到 OSTEONⅡ人工骨植入物結構更為疏松,孔隙直徑較大。而未處理牙粉脫礦牙本質層全層塌陷,膠原纖維結構塌陷縮小,無特定結構。見圖 2。
2.2 人牙骨移植材料與細胞共培養單光子共聚焦顯微鏡觀察
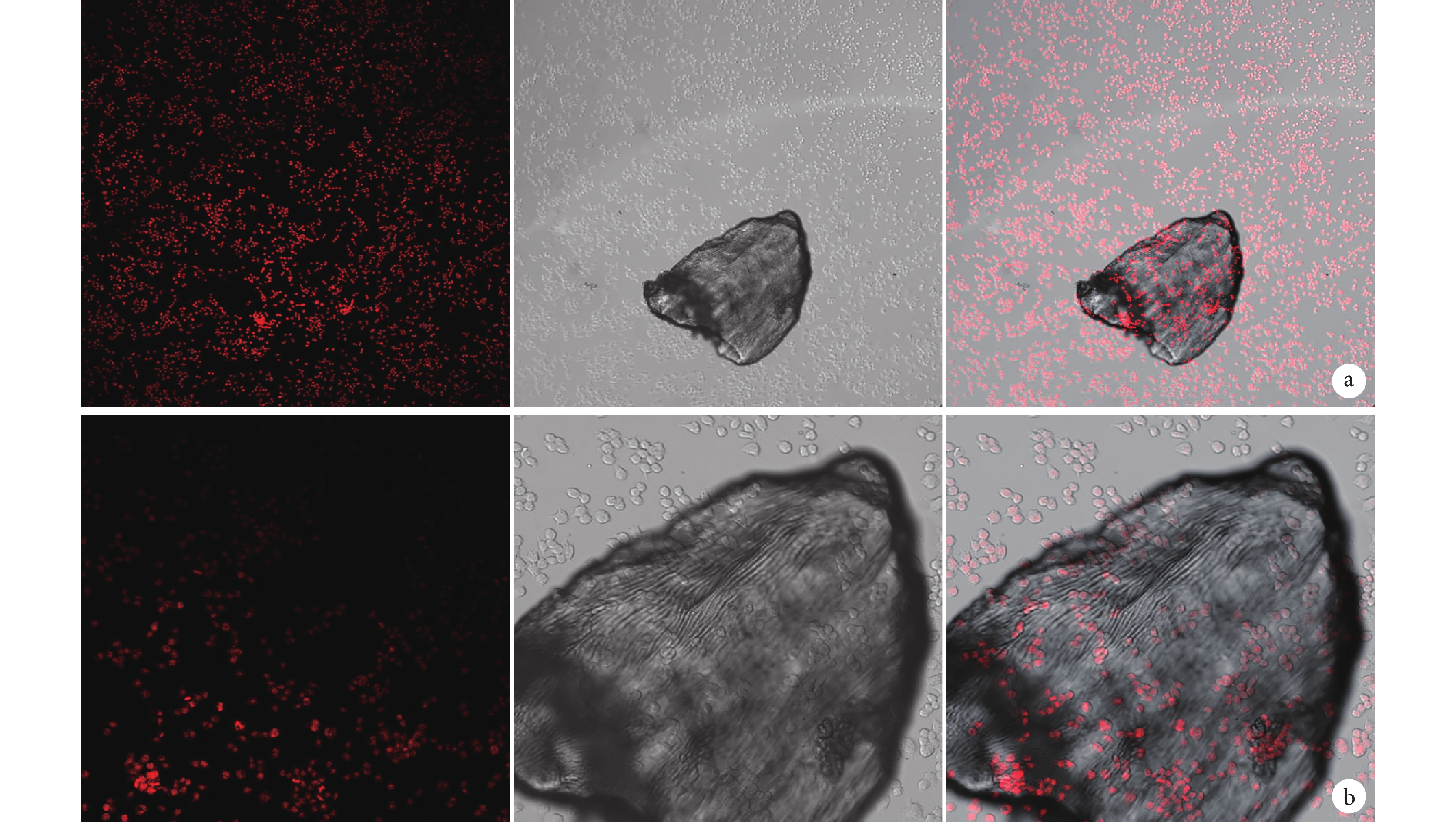
小鼠單核巨噬細胞 RAW264.7 為半懸浮細胞,貼壁前為球形,極少數貼壁后呈分枝狀。與人牙骨移植材料共培養后觀察顯示,細胞生長的狀態、密度及培養液顏色正常,細胞生長良好,鋪展正常。低倍鏡下可見細胞數量正常,高倍鏡下可見細胞在形態上與正常細胞無明顯差別,極少數呈分枝狀,能夠很好地黏附在材料顆粒上。見圖 3。
2.3 細胞形態學觀察法定性檢測細胞毒性
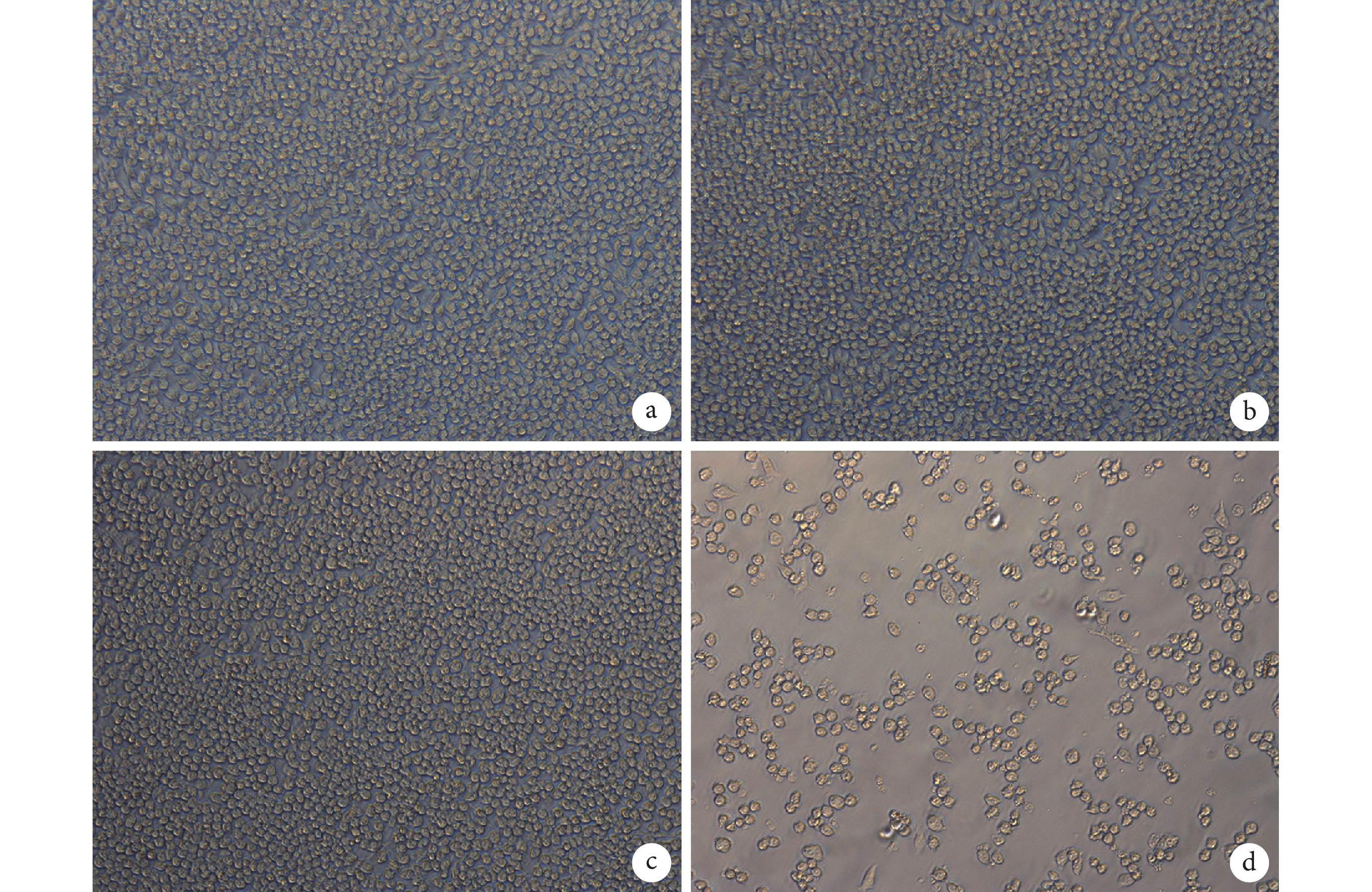
倒置顯微鏡觀察示,與 A 組相比,B、C 組細胞狀態無明顯差別,細胞大多呈圓形,形態正常,貼壁良好,排列均勻緊密,未出現溶解;而 D 組細胞數量較少,培養板中有懸浮細胞,疏松貼壁,可見圓亮懸浮死細胞。根據細胞毒性反應分級標準,A、B、C 組毒性反應分級均為 0 級,而 D 組為 3 級。見圖 4。
2.4 MTT 檢測細胞毒性
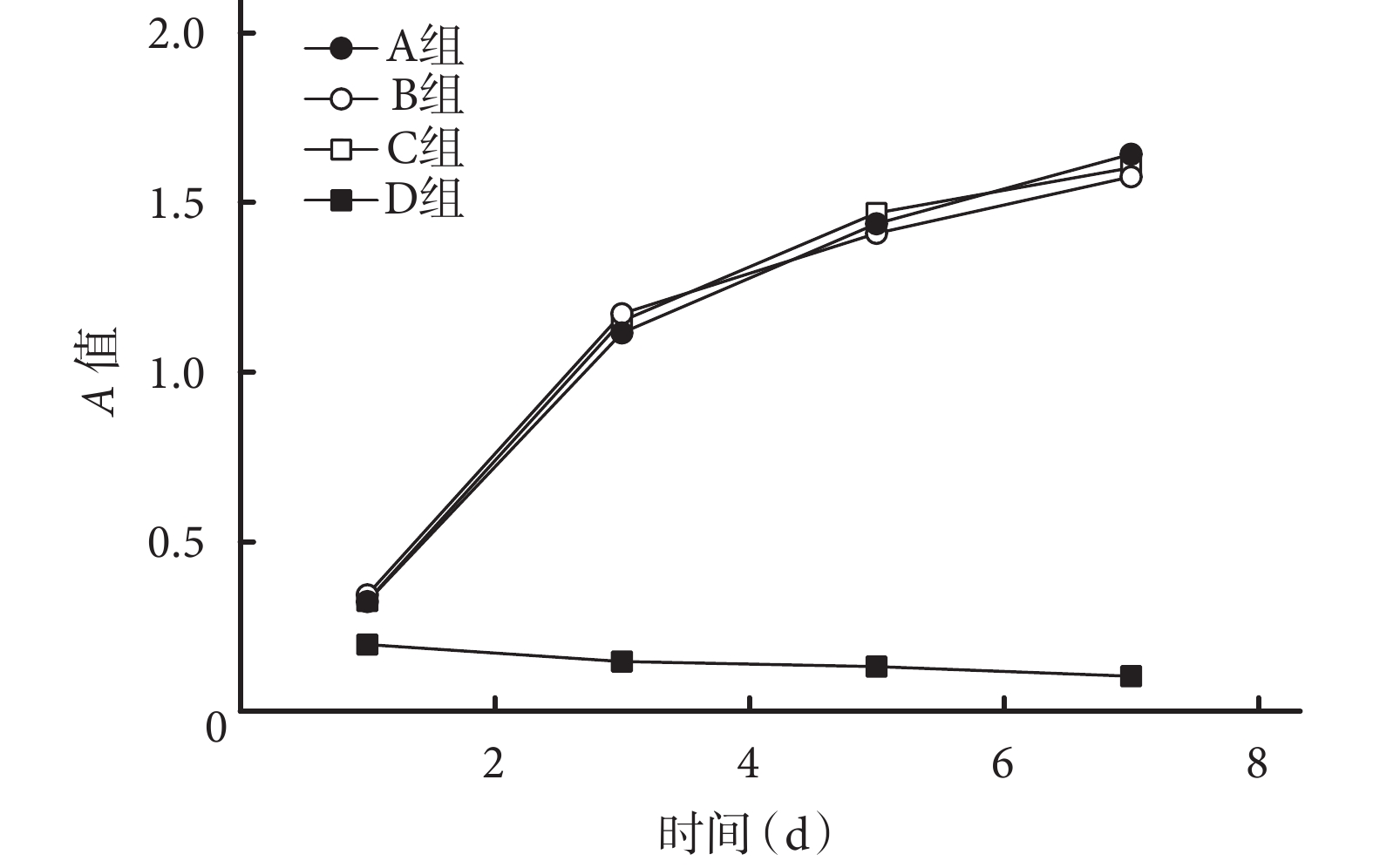
隨時間增加 A、B、C 組的 A 值均逐漸上升,而 D 組 A 值逐漸下降;A、B、C 組的 A 值均高于 D 組,差異有統計學意義(P<0.05),A、B、C 組間比較差異無統計學意義(P>0.05)。見圖 5。B、C 組各時間點細胞毒性均為 0 級或 1 級,提示材料合格。D 組培養 1 d 時細胞毒性為 2 級,3、5、7 d 均為 4 級,結合細胞形態分析,提示材料不合格。見表 2。
2.5 錐蟲藍染色檢測細胞活力
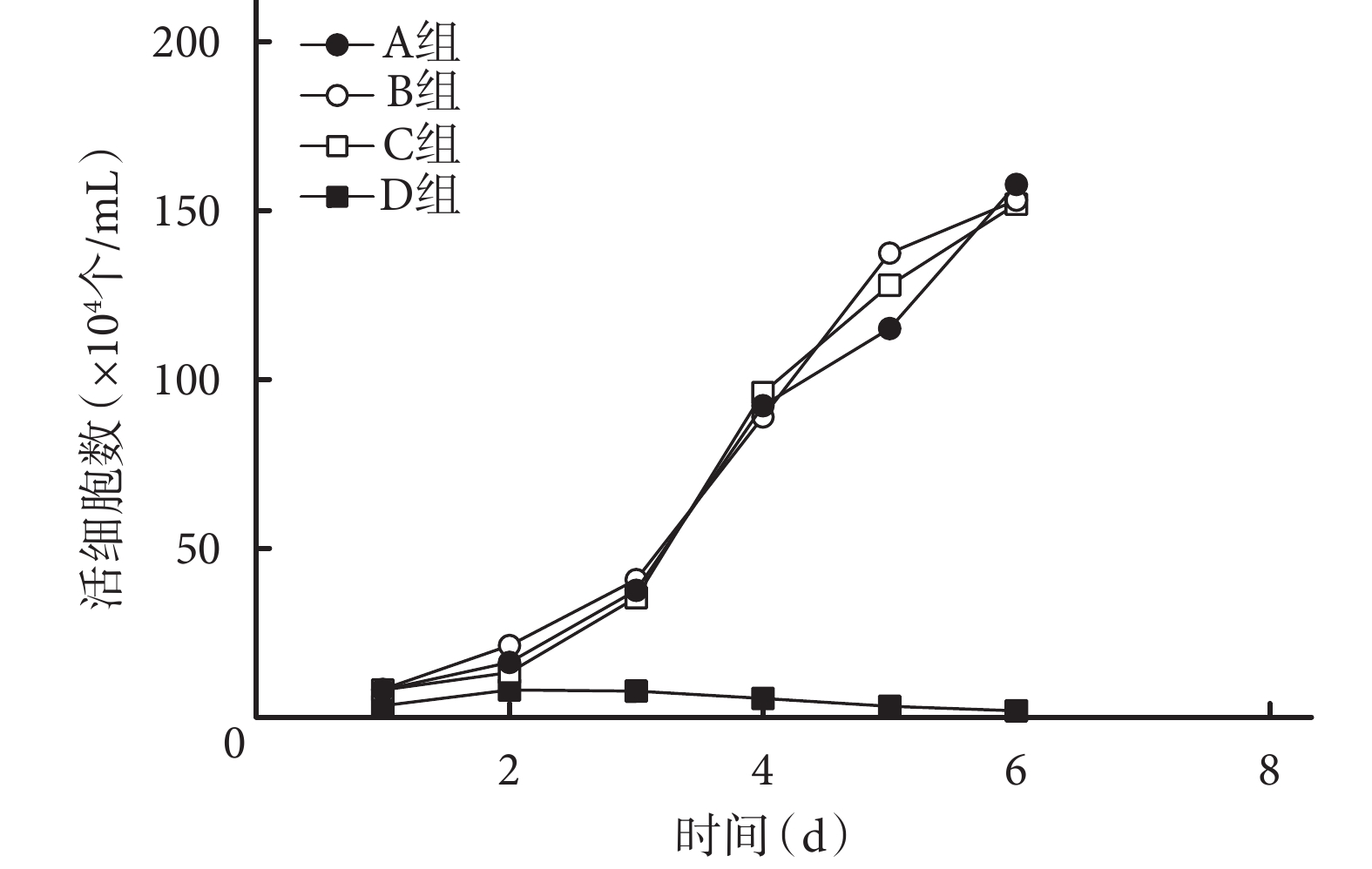
錐蟲藍染色示,隨培養時間延長,A、B、C 組細胞數量逐漸增加,1~3 d 時細胞數量增加緩慢,3~5 d 快速增殖,5~6 d 增長趨勢逐漸降低;D 組細胞出現生長抑制,隨時間延長,細胞數量逐漸減少。各時間點 A、B、C 組細胞數量均顯著高于 D 組,差異有統計學意義(P<0.05);A、B、C 組間差異無統計學意義(P>0.05)。見圖 6。
2.6 ELISA 檢測炎性因子分泌
ELISA 檢測示,隨培養時間延長,各組 TNF-α 含量均呈逐漸增加趨勢;D 組 IL-6 含量呈逐漸增加趨勢,A、B、C 組 IL-6 含量于 3 d 時達高峰,后逐漸降低。各時間點 A、B、C 組 TNF-α 和 IL-6 含量均顯著低于 D 組,差異有統計學意義(P<0.05);A、B、C 組間差異無統計學意義(P>0.05)。見表 3。
 )
Table3.
Comparison of TNF-α and IL-6 levels in each group at different time points (n=3,
)
Table3.
Comparison of TNF-α and IL-6 levels in each group at different time points (n=3,
 )
)
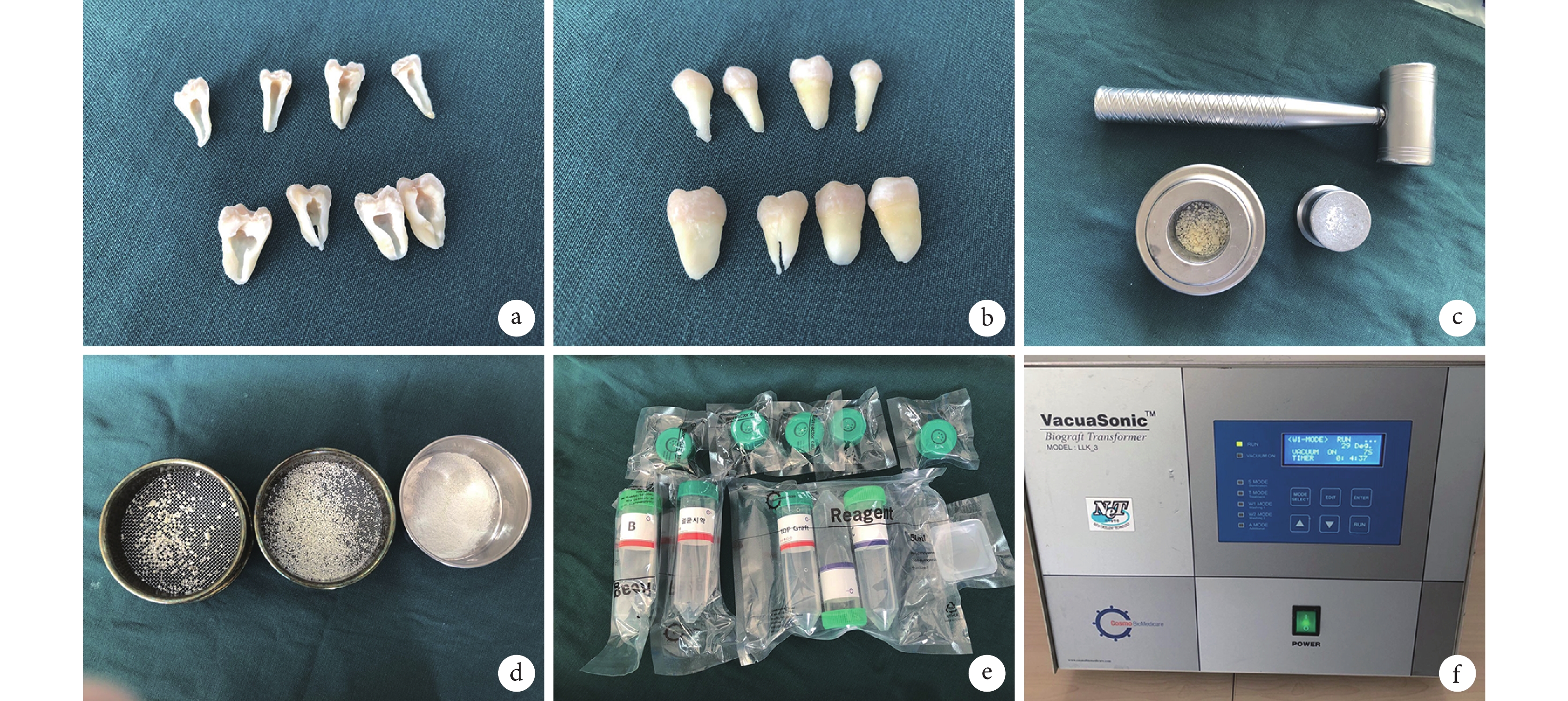 圖1
人牙骨移植材料的制備
圖1
人牙骨移植材料的制備
a、b. 去除牙髓后的備用牙齒;c. 將牙齒粉碎為 1 mm 顆粒的工具;d. 粉碎后的牙齒顆粒;e. 處理試劑;f. 人牙骨移植材料制作設備
Figure1. Preparation of human tooth bone graft materialsa, b. Removal of spare teeth after dental pulp; c. Tool for crushing teeth into 1 mm particles; d. Crushed particles; e. Treatment reagent; f. Device for human tooth bone graft materials
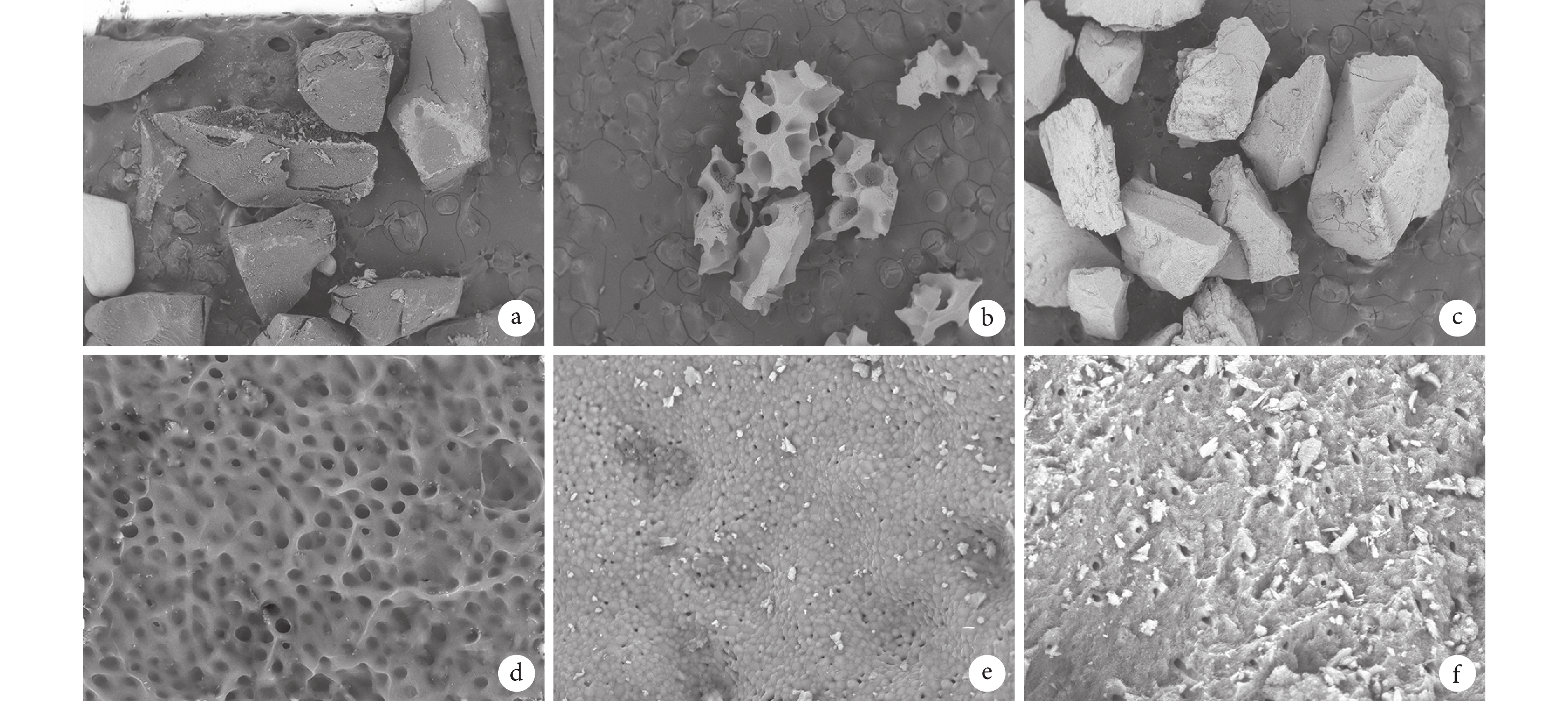 圖2
掃描電鏡觀察
圖2
掃描電鏡觀察
a. 人牙骨移植材料(×50); b. OSTEONⅡ人工骨植入物(×50);c. 未處理牙粉(×50);d. 人牙骨移植材料(×3 000);e. OSTEONⅡ人工骨植入物(×3 000);f. 未處理牙粉(×3 000)
Figure2. Scanning electron microscope observationa. Human tooth bone graft material (×50); b. OSTEONⅡ synthetic highly resorbable bone grafting material (×50); c. Untreated tooth powder (×50); d. Human tooth bone graft material (×3 000); e. OSTEONⅡ synthetic highly resorbable bone grafting material (×3 000); f. Untreated tooth powder (×3 000)
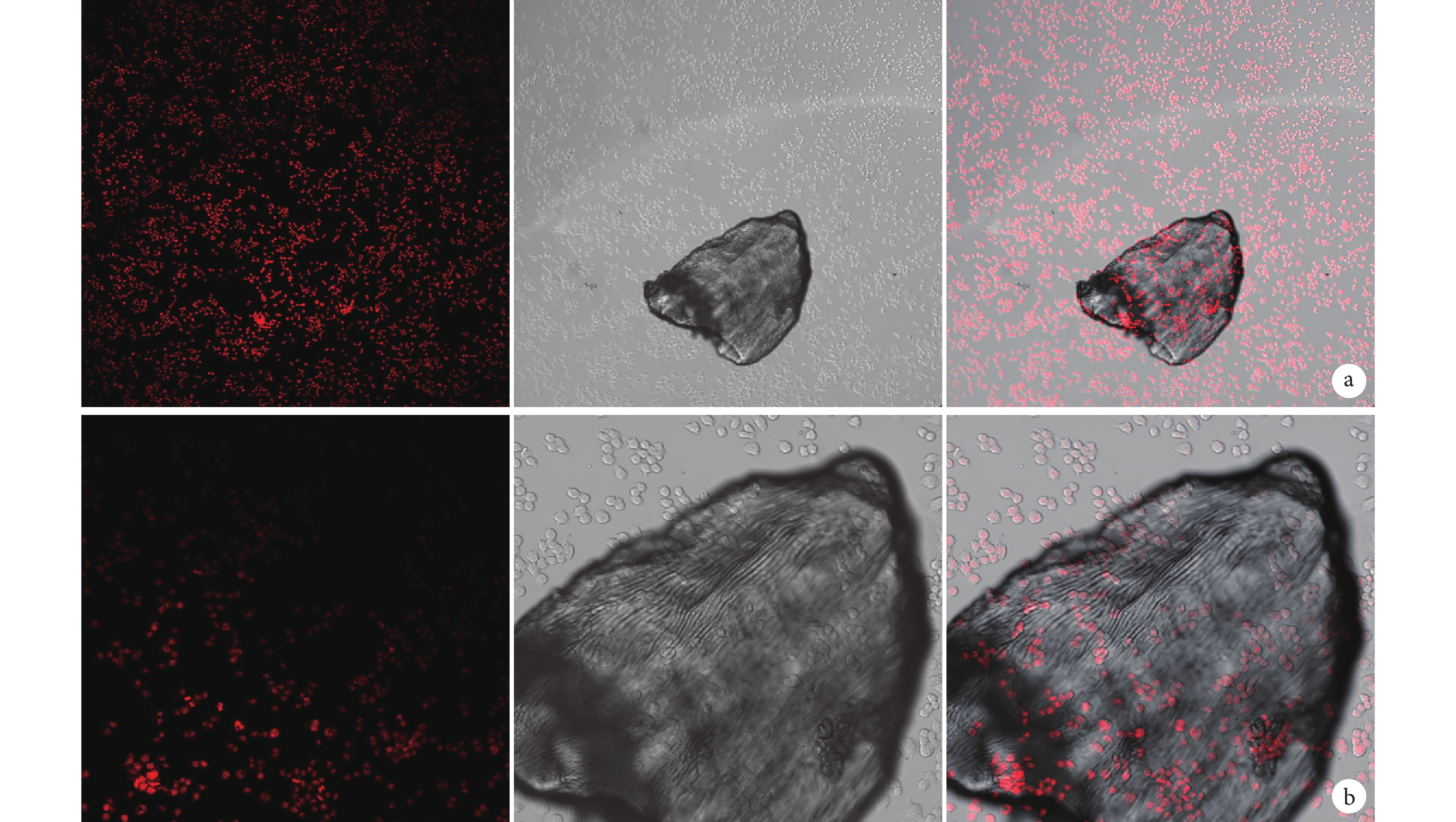 圖3
人牙骨移植材料與細胞共培養觀察
圖3
人牙骨移植材料與細胞共培養觀察
從左至右分別為單光子共聚焦顯微鏡觀察、光鏡觀察及二者重疊 a. ×100;b. ×300
Figure3. Co-culture observation of human tooth bone graft materials and cellsFrom left to right for single photon confocal microscopy observation, light microscopy observation, and merge a. ×100; b. ×300
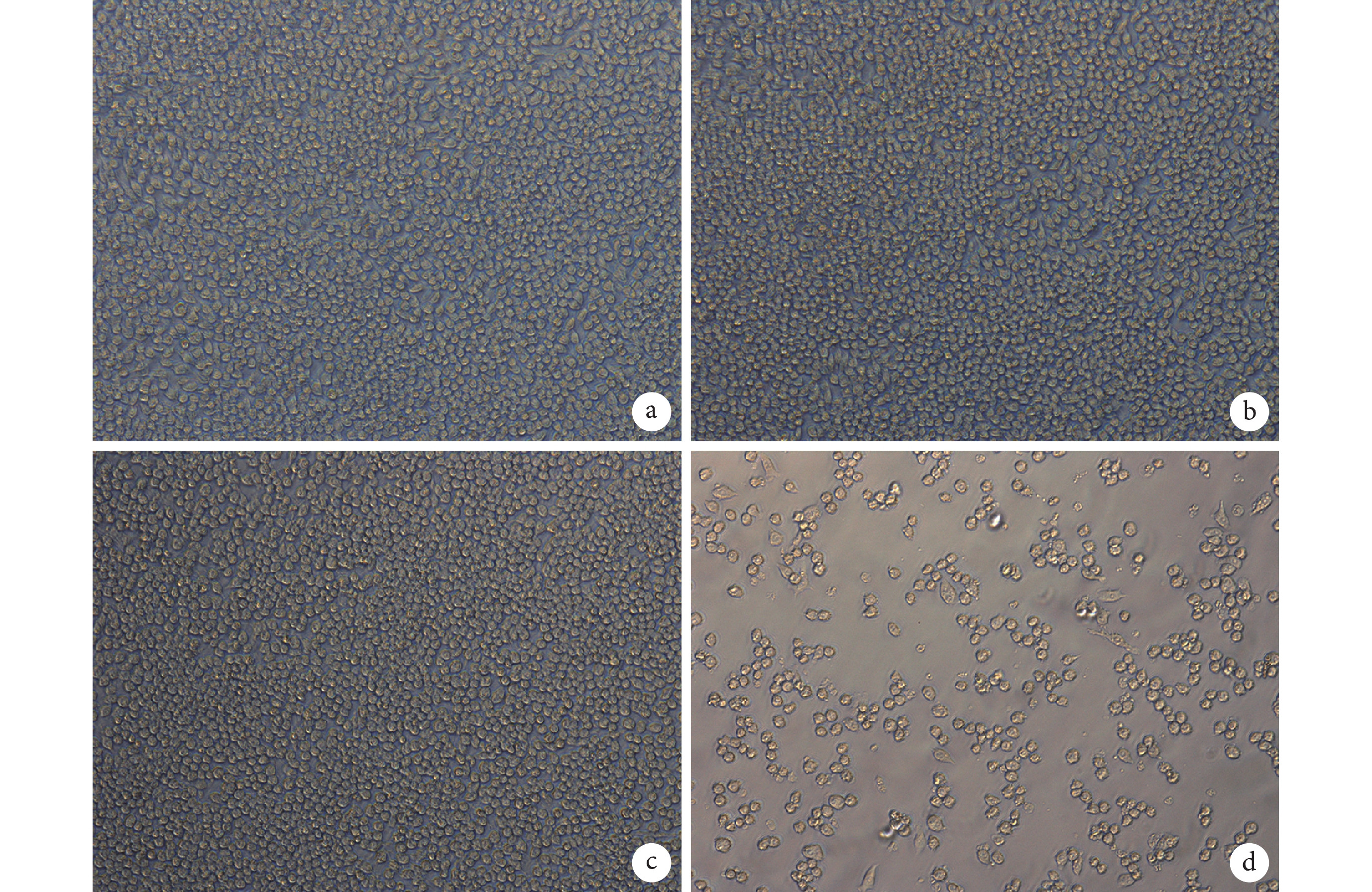 圖4
細胞與各組材料浸提液共培養 7 d 生長形貌觀察(倒置顯微鏡×200)
圖4
細胞與各組材料浸提液共培養 7 d 生長形貌觀察(倒置顯微鏡×200)
a. A 組;b. B 組;c. C 組;d. D 組
Figure4. Growth morphology observation of cells co-cultured with extracts of each component for 7 days (Inverted microscope×200)a. Group A; b. Group B; c. Group C; d. Group D
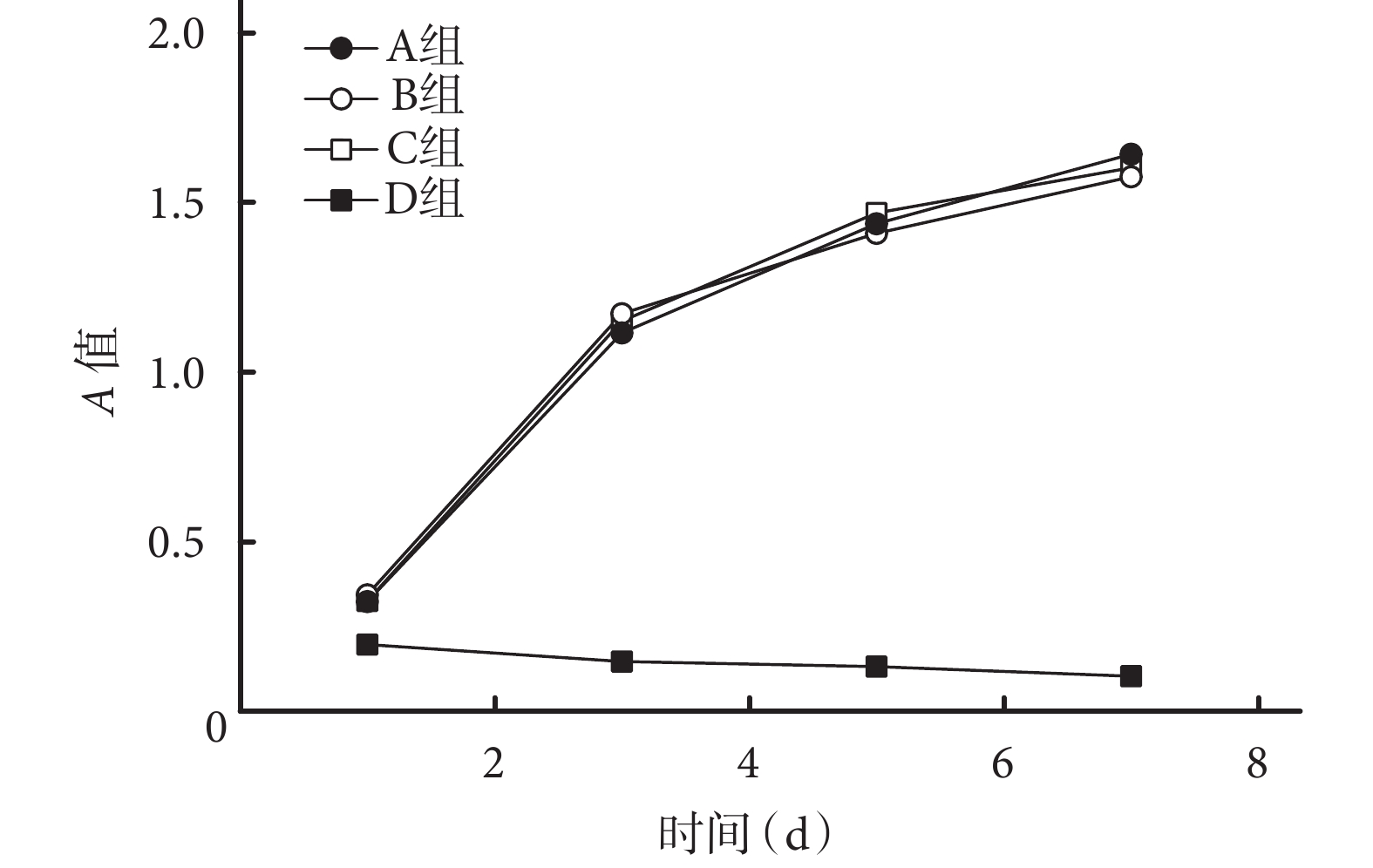 圖5
MTT 檢測 RAW264.7 細胞在不同材料浸提液中的增殖情況
Figure5.
The proliferation of RAW264.7 cells in different material extracts examined by MTT assay
圖5
MTT 檢測 RAW264.7 細胞在不同材料浸提液中的增殖情況
Figure5.
The proliferation of RAW264.7 cells in different material extracts examined by MTT assay
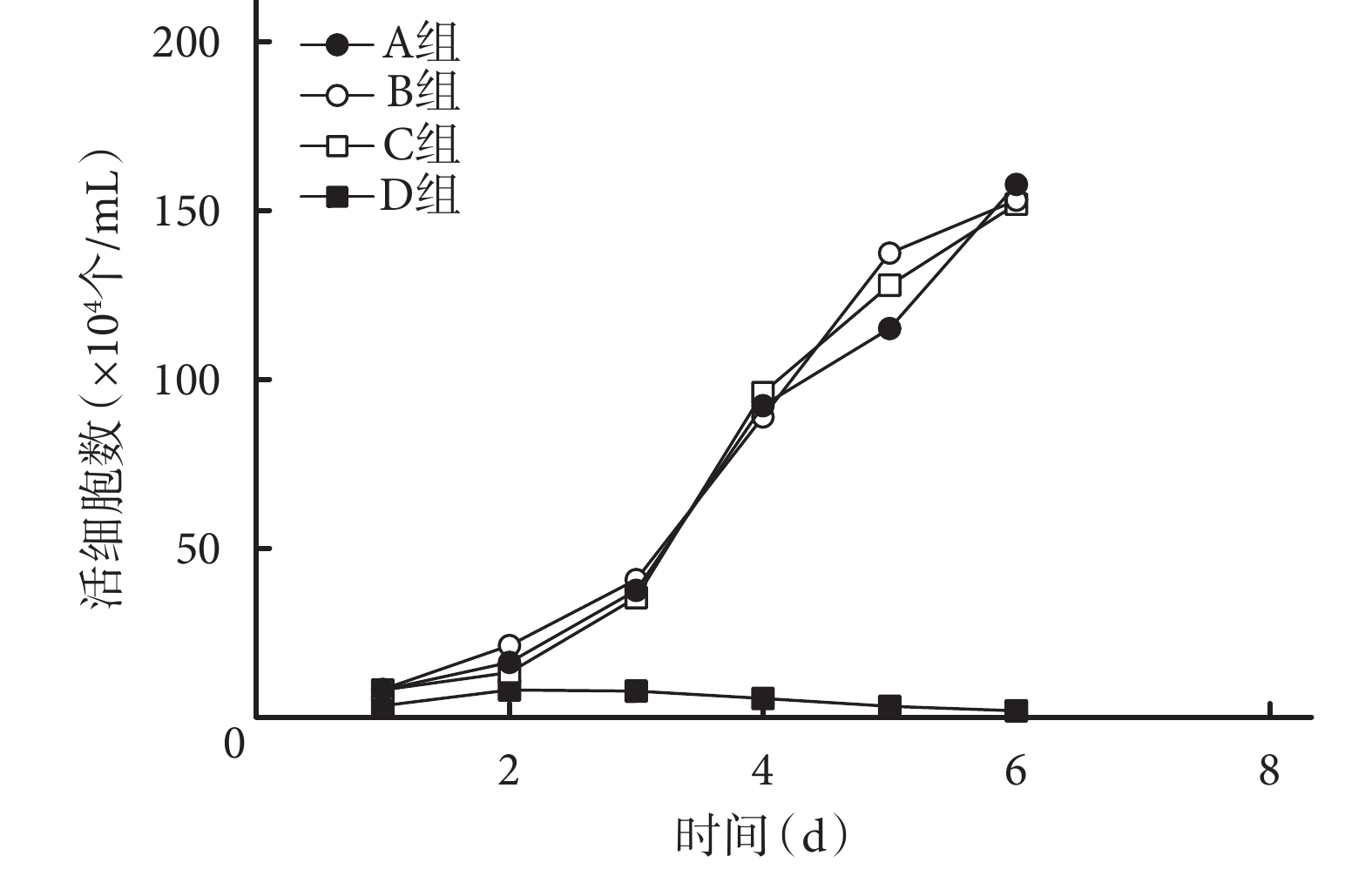 圖6
錐蟲藍染色檢測各組細胞生長曲線
Figure6.
Cell growth curves of each group detected by trypano soma blue staining
圖6
錐蟲藍染色檢測各組細胞生長曲線
Figure6.
Cell growth curves of each group detected by trypano soma blue staining
3 討論
面臨口腔種植受植區骨量不足以及修復重建外科對骨移植材料的需求,骨移植材料隨著骨組織工程學科的發展不斷優化設計,除了傳統的自體骨和異種骨之外,復合材料骨移植也已取得了很大成功,例如 OSTEONⅡ人工骨植入物,是由 30% 羥基磷灰石和 70%β-磷酸三鈣人工合成的復合材料,與人體松質骨極為相似,具有良好的骨引導性,可高效引導骨組織再生[6-7]。近年來出現了有關人牙骨移植材料作為一種具有骨誘導性的新型骨替代材料的報道[8-14]。人牙骨移植材料在韓國已廣泛應用于臨床,本課題組在臨床上應用自體松動或折斷的牙齒作為牙骨移植材料修復骨量不足的牙種植區,也取得了很好的臨床效果。我們應用兔同種異體牙骨移植材料修復兔顱骨缺損,形成的新骨質量好于成品生物骨移植材料[4],但關于牙骨移植材料的生物學特點,仍需要進一步研究。本實驗將人牙骨移植材料與 OSTEONⅡ人工骨植入物和未處理牙粉進行比較,首先通過掃描電鏡對 3 種材料的形貌進行了分析,相較于未處理的牙粉表面結構,人牙骨移植材料和 OSTEONⅡ人工骨植入物表面都具有均勻的孔狀結構,這種材料的多孔性有利于新生血管和骨組織生長。
所有的生物移植材料還必須具有良好的生物相容性。材料植入體內最常見的反應是免疫排斥反應。由于單核巨噬細胞來源于血液,在免疫系統中起著重要作用[15-18],因此本實驗選擇單核巨噬細胞作為評價材料細胞毒性的實驗細胞。在評價生物材料的組織相容性以及生物安全性時,細胞毒性測定是一種常用實驗方法。通過直接接觸法不僅能直接檢測材料溶出物的細胞毒性,同時也是考察材料與組織細胞相容性的重要手段。直接接觸法對材料的細胞毒性敏感性最高,可測出材料微弱的毒性。因此本實驗將人牙骨移植材料與單核巨噬細胞 RAW264.7 共培養,PI 染色后通過共聚焦顯微鏡觀察細胞對材料的黏附,根據直接接觸法細胞培養結果判斷材料的細胞毒性以及進行后續實驗的可行性。
對于材料生物相容性的評價往往通過細胞形態改變和數量增減來判斷,因為材料毒性成分對細胞損傷會導致細胞形態和數量的變化[19-22]。對于表面積不易測量的不規則形狀材料,為了后期實驗方便,我們采用材料浸提液的方法對細胞毒性進行評價。取人牙骨移植材料、OSTEONⅡ人工骨植入物和未處理牙粉 3 組材料的浸提液并設置含 10%FBS 的 DMEM 培養液作為空白對照。根據細胞形態學觀察法及 MTT 法分別定性和定量檢測細胞毒性,并通過錐蟲藍染色對比各材料浸提液對細胞 1~6 d 的生長曲線,進而檢測細胞活力變化。
單核巨噬細胞是重要的免疫細胞,能夠釋放各種刺激因子激活補體,引起急慢性炎性反應[23-24]。巨噬細胞分泌的 TNF-α 在引發炎癥中占重要作用,并可激活巨噬細胞的細胞因子。IL-6 是由巨噬細胞分泌產生的內毒素,它既能影響炎性反應,又能影響獲得性免疫,是急性反應和敗血性休克的主要介質[25-26]。本實驗通過檢測促炎性因子 TNF-α 和 IL-6 的釋放量,有助于了解材料植入人體內引起的炎性反應對組織細胞的影響。結果顯示,與空白對照組比較,人牙骨移植材料和 OSTEONⅡ人工骨植入物對小鼠單核巨噬細胞 RAW264.7 的細胞毒性方面無明顯差異,并且此兩組材料浸提液作用于細胞時,并不會增加炎性因子 TNF-α 和 IL-6 的表達;而未處理牙粉浸提液對小鼠單核巨噬細胞 RAW264.7 細胞毒性大,促炎性因子的分泌量較高。
本實驗結果顯示,人牙骨移植材料表現出良好的生物相容性,結合文獻分析,我們推測可能原因是:牙體組織除牙髓外都是高度礦化的硬組織,大部分是由含鈣磷離子的磷灰石晶體等磷酸鹽組成的無機物,其中少量有機物主要由具有良好生物相容性的Ⅰ型膠原蛋白構成[27-28];在制備人牙骨移植材料時,首先就去除了牙齒及其周圍的軟組織(牙髓、牙周膜),所以剩下絕大部分就是無機物和Ⅰ型膠原蛋白構成[29-30],再有極少數有機物經過 ToothOsteoPlant Graft Process 試劑和 VacuaSonic 真空超聲波牙齒脫鈣加速器脫脂、脫鈣和消毒處理后,就會將其中的有害物質去除,使得人牙骨移植材料幾乎不引起免疫反應。在以骨組織為原料制備骨移植材料過程中,去除骨組織的骨髓細胞和蛋白,是降低免疫原性的重要過程[31]。而脂類的存在也能夠誘發巨噬細胞產生炎性反應,并且可阻礙細胞的附著[32-33]。本實驗中未處理牙粉僅用純化水處理,并不能徹底去除牙齒中的非膠原蛋白、脂類以及材料表面殘留的部分細胞成分,過多的脂肪殘留可能存有引起細胞毒性的成分,而使其抗原性較高,因而在實驗中表現出相對較高的炎性因子表達。
綜上述,人牙骨移植材料在體外實驗中表現出良好的生物相容性,但體外細胞模型不能取代動物模型來評價生物材料誘導的炎性反應,僅僅是新型骨移植材料獲取與其接觸細胞的行為信息的初始步驟,有關人牙骨移植材料的其他生物學性能尚有待進一步研究明確。
任何一種生物材料應用于臨床,不僅需要具備與機體組織相匹配的理化特性和生物力學性能,還應首先具備使用安全性和良好的生物相容性,這是生物材料獲準臨床使用的前提[1]。近年來,骨移植材料在口腔種植手術中對于修復骨量不足的應用越來越受到重視,骨替代材料的研究和新型材料的研發,成為口腔種植外科和修復重建外科領域的研究熱點。有研究表明,人牙齒硬組織主要成分是高純度的羥基磷灰石,具有與人骨相似的鈣磷比和孔隙結構,是一種潛在的理想骨缺損修復材料[2-3]。王媛等[4]研究證實牙骨移植材料在大鼠體內可以達到良好的骨修復效果,但對于人牙骨移植材料這種新型材料體外的安全性和生物相容性研究相對少見。為探討人牙骨移植材料體外生物相容性,本研究建立了以小鼠單核巨噬細胞為靶細胞的模型,制作人牙骨移植材料,以臨床常見的 OSTEONⅡ人工骨植入物進行對比,研究小鼠單核巨噬細胞在人牙骨移植材料和 OSTEONⅡ人工骨植入物上的增殖與分化活性,為人牙骨移植材料的進一步開發和臨床應用提供實驗依據。
1 材料與方法
1.1 實驗細胞與主要試劑、儀器
小鼠單核巨噬細胞 RAW264.7,由中國科學院典型培養物保藏委員會細胞庫提供。OSTEONⅡ人工骨植入物[登騰(北京)器械商貿有限公司,批號 17F22-02,型號 DT7G0510050]。DMEM 培養基(HyClone 公司,美國);青鏈霉素雙抗(GIBCO 公司,美國);FBS(杭州天杭生物科技有限公司);MTT 試劑盒(上海碧云天生物技術有限公司);錐蟲藍、DMSO(北京索萊寶科技有限公司);碘化丙啶(propidium iodide,PI)染色劑(上海翊圣生物科技有限公司);TNF-α ELISA 試劑盒、IL-6 ELISA 試劑盒(北京誠林生物科技有限公司);ToothOsteoPlant Graft Process Kit(COSMO 公司,韓國)。VacuaSonic 真空超聲波牙齒脫鈣加速器(COSMO 公司,韓國);單光子共聚焦顯微鏡(Leica 公司,德國);倒置相差顯微鏡(Olympus 公司,日本);多功能酶標儀(TECAN 公司,瑞士);血球計數板(MARIENFELD 公司,德國)。
1.2 材料制備方法
1.2.1 人牙骨移植材料的制備
收集錦州醫科大學附屬第二醫院口腔外科及種植科近 1 周內拔除的新鮮離體牙,主要為第 3 磨牙、正畸拔除牙、牙周病晚期無法保留的活髓牙以及外傷無法修復的牙。將收集的離體牙去除軟組織、齲壞組織及色素沉著,專用器械將干燥后的人離體牙加工成約為 1 mm 大小的顆粒狀,按照 ToothOsteoPlant Graft Process Kit 試劑盒說明書,通過 VacuaSonic 真空超聲波牙齒脫鈣加速器處理,得到人牙骨移植材料,4℃ 封存備用。見圖 1。
1.2.2 OSTEONⅡ人工骨植入物
該材料為無菌密封,注意無菌操作,直接用于實驗。
1.2.3 未處理牙粉的制備
按人牙骨移植材料制備的納入標準以及制備方法,將收集的新鮮離體牙去除軟組織后,制備成約 1 mm 大小的顆粒,不經試劑處理,直接用含有 500 U/mL 青鏈霉素雙抗的三蒸水浸泡 10 min,用三蒸水反復沖洗,冷凍干燥,4℃ 保存備用。
1.3 觀測指標
1.3.1 掃描電鏡觀察材料形貌
將制備的人牙骨移植材料、OSTEONⅡ人工骨植入物、未處理牙粉冷凍干燥,噴金,掃描電鏡觀察各材料形貌。
1.3.2 人牙骨移植材料與細胞共培養單光子共聚焦顯微鏡觀察
取對數生長期小鼠單核巨噬細胞 RAW264.7,在含有細胞爬片的 6 孔板中每孔接種 1×106 個細胞,加入 1 500 mg/mL 人牙骨移植材料共同培養 24 h 后,PBS 沖洗,多聚甲醛固定,PI 染色,1 h 內單光子共聚焦顯微鏡觀察。
1.3.3 材料浸提液制備及分組
按照 ISO 10993-12 標準制備各材料浸提液。根據浸提液中的不同成分分為 4 組:A 組為含 10%FBS 的 DMEM 培養液,B 組為人牙骨移植材料,C 組為 OSTEONⅡ人工骨植入物,D 組為未處理牙粉。用于以下觀測。
1.3.4 細胞形態學觀察法定性檢測細胞毒性
取對數生長期小鼠單核巨噬細胞 RAW264.7,按 2×104 個/mL 密度接種于 6 孔板中,每孔 2 mL。貼壁后,分別采用 4 組浸提液培養,7 d 后倒置顯微鏡觀察。隨機選取視野進行拍照,每組取 3 張圖片觀察細胞生長狀況及形態變化,按《GB/T16886.5-2003 醫療器械生物學評價第 5 部分:體外細胞毒性試驗》細胞毒性反應分級標準判定,以評價材料對細胞生長的影響[5]。見表 1。陰性對照組的反應不大于 1 級,陽性對照組至少為 3 級反應。
1.3.5 MTT 檢測細胞增殖分化及細胞毒性
取對數生長期小鼠單核巨噬細胞 RAW264.7,按 2×104個/mL 密度接種于 96 孔板中,每孔 100 μL;24 h 后分別用 4 組浸提液培養,每組設 10 個平行孔。于培養 1、3、5、7 d 時,加入 20 μL MTT(5 mg/mL)孵育 4 h,DMSO 震蕩溶解,酶標儀檢測 492 nm 處的吸光度(A)值。按以下公式計算細胞相對增殖率(relative growth rate,RGR)評價細胞毒性:RGR=(實驗組 A 值/A 組 A 值)×100%。實驗重復 3 次,取均值。按以下標準評價細胞毒性:0 級,RGR≥100%;1 級,RGR 75%~100%;2 級,RGR 50%~75%;3 級,RGR 25%~50%;4 級,RGR 1%~25%;5 級,RGR 為 0。細胞毒性為 0~1 級說明材料合格,3~5 級為不合格,2 級反應結合細胞形態綜合評價。
1.3.6 錐蟲藍染色檢測細胞活力
取對數生長期小鼠單核巨噬細胞 RAW264.7,按 2×104個/mL 密度接種于 24 孔板中,每孔 0.5 mL。貼壁后,分別用 4 組浸提液培養,每組設 3 個平行孔。于培養 1、2、3、4、5、6 d 時每組各取細胞懸液 40 μL,加 0.4% 錐蟲藍 10 μL,3 min 內用血球計數儀計數,倒置顯微鏡下觀察,死細胞被染成藍色,活細胞則拒染,透明不著色。計數各組活細胞并繪制細胞生長曲線。
1.3.7 ELISA 檢測炎性因子分泌
取對數生長期小鼠單核巨噬細胞 RAW264.7,按 2×104個/mL 密度接種于 24 孔板中,每孔 0.5 mL,貼壁后,分別用 4 組浸提液培養,每組設 3 個平行孔。于培養 1、3、5 d 分別收集各組細胞上清,按 ELISA 試劑盒說明書方法檢測炎性因子 TNF-α和 IL-6 的表達。
1.4 統計學方法
采用 SPSS17.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;檢驗水準 α=0.05。
2 結果
2.1 掃描電鏡觀察材料形貌
與未處理牙粉比較,人牙骨移植材料和 OSTE-ONⅡ人工骨植入物表面都具有均勻的孔狀結構,在高倍鏡下人牙骨移植材料能觀察到致密多孔結構,OSTEONⅡ人工骨植入物表面更為疏松;在低倍鏡下觀察到 OSTEONⅡ人工骨植入物結構更為疏松,孔隙直徑較大。而未處理牙粉脫礦牙本質層全層塌陷,膠原纖維結構塌陷縮小,無特定結構。見圖 2。
2.2 人牙骨移植材料與細胞共培養單光子共聚焦顯微鏡觀察
小鼠單核巨噬細胞 RAW264.7 為半懸浮細胞,貼壁前為球形,極少數貼壁后呈分枝狀。與人牙骨移植材料共培養后觀察顯示,細胞生長的狀態、密度及培養液顏色正常,細胞生長良好,鋪展正常。低倍鏡下可見細胞數量正常,高倍鏡下可見細胞在形態上與正常細胞無明顯差別,極少數呈分枝狀,能夠很好地黏附在材料顆粒上。見圖 3。
2.3 細胞形態學觀察法定性檢測細胞毒性
倒置顯微鏡觀察示,與 A 組相比,B、C 組細胞狀態無明顯差別,細胞大多呈圓形,形態正常,貼壁良好,排列均勻緊密,未出現溶解;而 D 組細胞數量較少,培養板中有懸浮細胞,疏松貼壁,可見圓亮懸浮死細胞。根據細胞毒性反應分級標準,A、B、C 組毒性反應分級均為 0 級,而 D 組為 3 級。見圖 4。
2.4 MTT 檢測細胞毒性
隨時間增加 A、B、C 組的 A 值均逐漸上升,而 D 組 A 值逐漸下降;A、B、C 組的 A 值均高于 D 組,差異有統計學意義(P<0.05),A、B、C 組間比較差異無統計學意義(P>0.05)。見圖 5。B、C 組各時間點細胞毒性均為 0 級或 1 級,提示材料合格。D 組培養 1 d 時細胞毒性為 2 級,3、5、7 d 均為 4 級,結合細胞形態分析,提示材料不合格。見表 2。
2.5 錐蟲藍染色檢測細胞活力
錐蟲藍染色示,隨培養時間延長,A、B、C 組細胞數量逐漸增加,1~3 d 時細胞數量增加緩慢,3~5 d 快速增殖,5~6 d 增長趨勢逐漸降低;D 組細胞出現生長抑制,隨時間延長,細胞數量逐漸減少。各時間點 A、B、C 組細胞數量均顯著高于 D 組,差異有統計學意義(P<0.05);A、B、C 組間差異無統計學意義(P>0.05)。見圖 6。
2.6 ELISA 檢測炎性因子分泌
ELISA 檢測示,隨培養時間延長,各組 TNF-α 含量均呈逐漸增加趨勢;D 組 IL-6 含量呈逐漸增加趨勢,A、B、C 組 IL-6 含量于 3 d 時達高峰,后逐漸降低。各時間點 A、B、C 組 TNF-α 和 IL-6 含量均顯著低于 D 組,差異有統計學意義(P<0.05);A、B、C 組間差異無統計學意義(P>0.05)。見表 3。
 )
Table3.
Comparison of TNF-α and IL-6 levels in each group at different time points (n=3,
)
Table3.
Comparison of TNF-α and IL-6 levels in each group at different time points (n=3,
 )
)
 圖1
人牙骨移植材料的制備
圖1
人牙骨移植材料的制備
a、b. 去除牙髓后的備用牙齒;c. 將牙齒粉碎為 1 mm 顆粒的工具;d. 粉碎后的牙齒顆粒;e. 處理試劑;f. 人牙骨移植材料制作設備
Figure1. Preparation of human tooth bone graft materialsa, b. Removal of spare teeth after dental pulp; c. Tool for crushing teeth into 1 mm particles; d. Crushed particles; e. Treatment reagent; f. Device for human tooth bone graft materials
 圖2
掃描電鏡觀察
圖2
掃描電鏡觀察
a. 人牙骨移植材料(×50); b. OSTEONⅡ人工骨植入物(×50);c. 未處理牙粉(×50);d. 人牙骨移植材料(×3 000);e. OSTEONⅡ人工骨植入物(×3 000);f. 未處理牙粉(×3 000)
Figure2. Scanning electron microscope observationa. Human tooth bone graft material (×50); b. OSTEONⅡ synthetic highly resorbable bone grafting material (×50); c. Untreated tooth powder (×50); d. Human tooth bone graft material (×3 000); e. OSTEONⅡ synthetic highly resorbable bone grafting material (×3 000); f. Untreated tooth powder (×3 000)
 圖3
人牙骨移植材料與細胞共培養觀察
圖3
人牙骨移植材料與細胞共培養觀察
從左至右分別為單光子共聚焦顯微鏡觀察、光鏡觀察及二者重疊 a. ×100;b. ×300
Figure3. Co-culture observation of human tooth bone graft materials and cellsFrom left to right for single photon confocal microscopy observation, light microscopy observation, and merge a. ×100; b. ×300
 圖4
細胞與各組材料浸提液共培養 7 d 生長形貌觀察(倒置顯微鏡×200)
圖4
細胞與各組材料浸提液共培養 7 d 生長形貌觀察(倒置顯微鏡×200)
a. A 組;b. B 組;c. C 組;d. D 組
Figure4. Growth morphology observation of cells co-cultured with extracts of each component for 7 days (Inverted microscope×200)a. Group A; b. Group B; c. Group C; d. Group D
 圖5
MTT 檢測 RAW264.7 細胞在不同材料浸提液中的增殖情況
Figure5.
The proliferation of RAW264.7 cells in different material extracts examined by MTT assay
圖5
MTT 檢測 RAW264.7 細胞在不同材料浸提液中的增殖情況
Figure5.
The proliferation of RAW264.7 cells in different material extracts examined by MTT assay
 圖6
錐蟲藍染色檢測各組細胞生長曲線
Figure6.
Cell growth curves of each group detected by trypano soma blue staining
圖6
錐蟲藍染色檢測各組細胞生長曲線
Figure6.
Cell growth curves of each group detected by trypano soma blue staining
3 討論
面臨口腔種植受植區骨量不足以及修復重建外科對骨移植材料的需求,骨移植材料隨著骨組織工程學科的發展不斷優化設計,除了傳統的自體骨和異種骨之外,復合材料骨移植也已取得了很大成功,例如 OSTEONⅡ人工骨植入物,是由 30% 羥基磷灰石和 70%β-磷酸三鈣人工合成的復合材料,與人體松質骨極為相似,具有良好的骨引導性,可高效引導骨組織再生[6-7]。近年來出現了有關人牙骨移植材料作為一種具有骨誘導性的新型骨替代材料的報道[8-14]。人牙骨移植材料在韓國已廣泛應用于臨床,本課題組在臨床上應用自體松動或折斷的牙齒作為牙骨移植材料修復骨量不足的牙種植區,也取得了很好的臨床效果。我們應用兔同種異體牙骨移植材料修復兔顱骨缺損,形成的新骨質量好于成品生物骨移植材料[4],但關于牙骨移植材料的生物學特點,仍需要進一步研究。本實驗將人牙骨移植材料與 OSTEONⅡ人工骨植入物和未處理牙粉進行比較,首先通過掃描電鏡對 3 種材料的形貌進行了分析,相較于未處理的牙粉表面結構,人牙骨移植材料和 OSTEONⅡ人工骨植入物表面都具有均勻的孔狀結構,這種材料的多孔性有利于新生血管和骨組織生長。
所有的生物移植材料還必須具有良好的生物相容性。材料植入體內最常見的反應是免疫排斥反應。由于單核巨噬細胞來源于血液,在免疫系統中起著重要作用[15-18],因此本實驗選擇單核巨噬細胞作為評價材料細胞毒性的實驗細胞。在評價生物材料的組織相容性以及生物安全性時,細胞毒性測定是一種常用實驗方法。通過直接接觸法不僅能直接檢測材料溶出物的細胞毒性,同時也是考察材料與組織細胞相容性的重要手段。直接接觸法對材料的細胞毒性敏感性最高,可測出材料微弱的毒性。因此本實驗將人牙骨移植材料與單核巨噬細胞 RAW264.7 共培養,PI 染色后通過共聚焦顯微鏡觀察細胞對材料的黏附,根據直接接觸法細胞培養結果判斷材料的細胞毒性以及進行后續實驗的可行性。
對于材料生物相容性的評價往往通過細胞形態改變和數量增減來判斷,因為材料毒性成分對細胞損傷會導致細胞形態和數量的變化[19-22]。對于表面積不易測量的不規則形狀材料,為了后期實驗方便,我們采用材料浸提液的方法對細胞毒性進行評價。取人牙骨移植材料、OSTEONⅡ人工骨植入物和未處理牙粉 3 組材料的浸提液并設置含 10%FBS 的 DMEM 培養液作為空白對照。根據細胞形態學觀察法及 MTT 法分別定性和定量檢測細胞毒性,并通過錐蟲藍染色對比各材料浸提液對細胞 1~6 d 的生長曲線,進而檢測細胞活力變化。
單核巨噬細胞是重要的免疫細胞,能夠釋放各種刺激因子激活補體,引起急慢性炎性反應[23-24]。巨噬細胞分泌的 TNF-α 在引發炎癥中占重要作用,并可激活巨噬細胞的細胞因子。IL-6 是由巨噬細胞分泌產生的內毒素,它既能影響炎性反應,又能影響獲得性免疫,是急性反應和敗血性休克的主要介質[25-26]。本實驗通過檢測促炎性因子 TNF-α 和 IL-6 的釋放量,有助于了解材料植入人體內引起的炎性反應對組織細胞的影響。結果顯示,與空白對照組比較,人牙骨移植材料和 OSTEONⅡ人工骨植入物對小鼠單核巨噬細胞 RAW264.7 的細胞毒性方面無明顯差異,并且此兩組材料浸提液作用于細胞時,并不會增加炎性因子 TNF-α 和 IL-6 的表達;而未處理牙粉浸提液對小鼠單核巨噬細胞 RAW264.7 細胞毒性大,促炎性因子的分泌量較高。
本實驗結果顯示,人牙骨移植材料表現出良好的生物相容性,結合文獻分析,我們推測可能原因是:牙體組織除牙髓外都是高度礦化的硬組織,大部分是由含鈣磷離子的磷灰石晶體等磷酸鹽組成的無機物,其中少量有機物主要由具有良好生物相容性的Ⅰ型膠原蛋白構成[27-28];在制備人牙骨移植材料時,首先就去除了牙齒及其周圍的軟組織(牙髓、牙周膜),所以剩下絕大部分就是無機物和Ⅰ型膠原蛋白構成[29-30],再有極少數有機物經過 ToothOsteoPlant Graft Process 試劑和 VacuaSonic 真空超聲波牙齒脫鈣加速器脫脂、脫鈣和消毒處理后,就會將其中的有害物質去除,使得人牙骨移植材料幾乎不引起免疫反應。在以骨組織為原料制備骨移植材料過程中,去除骨組織的骨髓細胞和蛋白,是降低免疫原性的重要過程[31]。而脂類的存在也能夠誘發巨噬細胞產生炎性反應,并且可阻礙細胞的附著[32-33]。本實驗中未處理牙粉僅用純化水處理,并不能徹底去除牙齒中的非膠原蛋白、脂類以及材料表面殘留的部分細胞成分,過多的脂肪殘留可能存有引起細胞毒性的成分,而使其抗原性較高,因而在實驗中表現出相對較高的炎性因子表達。
綜上述,人牙骨移植材料在體外實驗中表現出良好的生物相容性,但體外細胞模型不能取代動物模型來評價生物材料誘導的炎性反應,僅僅是新型骨移植材料獲取與其接觸細胞的行為信息的初始步驟,有關人牙骨移植材料的其他生物學性能尚有待進一步研究明確。