引用本文: 譚可可, 王秀秀, 張君, 莊志剛, 董鐵立. 殼聚糖多孔支架復合BMSCs移植修復大鼠創傷性腦損傷的實驗研究. 中國修復重建外科雜志, 2018, 32(6): 745-752. doi: 10.7507/1002-1892.201712047 復制
創傷性腦損傷(traumatic brain injury,TBI)是最常見的神經系統疾病之一,發病率呈逐年上升趨勢,其后遺癥嚴重影響患者生活質量,給家庭和社會造成極大的經濟負擔,已成為日益嚴重的公共衛生問題[1]。TBI 是中樞神經系統的一種進行性退行性病變,以細胞丟失為主要特征[2],TBI 后神經元的壞死、缺失、膠質瘢痕形成及神經環路中斷,可導致學習和記憶等功能障礙[3]。TBI 通過一種大腦修復和/或可塑機制來激活神經干細胞的增殖,但 TBI 后腦組織內部的神經干細胞增殖、遷移并分化為功能神經元的能力卻極為有限[4]。研究表明,神經干細胞腦內移植能夠促進損傷大鼠的神經行為和運動功能恢復,移植的神經干細胞能夠存活,向損傷灶遷移并分化為神經元[5]。但神經干細胞的研究和應用面臨倫理學限制。BMSCs 是從骨髓中分離培養而來的非造血干細胞,具有免疫原性低、抗纖維化和多向分化潛能,可分化為神經細胞、膠質細胞、脂肪細胞、成骨細胞及成軟骨細胞等,可充當多種器官改建或損傷后修復的細胞源[6-7]。有研究發現,在小鼠 TBI 后移植 BMSCs 能夠促進血管再生并改善神經功能[8]。生物材料可為移植的干細胞提供三維結構支持,并減少膠質瘢痕的形成[9]。殼聚糖性質穩定,具有較好的生物相容性和降解性,且對神經電活動幾乎無影響,顱內應用具有安全性,被廣泛應用于醫藥學、組織工程等領域[10]。MC3T3-E1 細胞在殼聚糖支架上培養時表現出快速增殖的潛能[11]。有研究發現殼聚糖-藻酸鹽支架與 BMSCs 復合構建的組織工程脊髓,對大鼠急性脊髓損傷修復有促進作用[12]。本研究擬將 BMSCs 與殼聚糖多孔支架共培養構建組織工程復合體,然后移植于大鼠 TBI 模型,觀察其能否改善大鼠神經功能。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
健康成年雄性 SD 大鼠 51 只,體質量(250±50)g,由鄭州大學動物中心提供,置于清潔、恒溫環境中飼養。
殼聚糖(上海生工生物工程股份有限公司);DMEM/F-12(1∶1)培養基、FBS[賽默飛世爾生物化學制品(北京)有限公司];0.25% 胰蛋白酶-0.02%EDTA(BioInd 公司,美國);FITC 標記的抗小鼠/大鼠 CD29 抗體、PE 標記的抗大鼠 CD45RA 抗體(BioLegend 公司,美國);抗 BrdU 抗體-增殖標記綿羊多克隆抗體(Abcam 公司,美國);抗高分子量神經絲蛋白(neurofilament triplet H,NF-H)(RMdO 20)小鼠單克隆抗體、抗神經膠質酸性蛋白(glial fibrillary acidic protein,GFAP)(GA5)小鼠單克隆抗體(CST 公司,美國);辣根過氧化物酶標記的親和兔抗綿羊 IgG(H+L)抗體(EarthOx 公司,美國);辣根過氧化物酶標記的山羊抗小鼠 IgG 抗體(北京中杉金橋生物技術有限公司);BrdU(Sigma 公司,美國);環孢素注射液(NOVARTIS 公司,瑞士)。
流式細胞儀(Becton Dicknson 公司,美國);掃描電鏡(Hitachi 公司,日本);酶聯免疫檢測儀(Biotek 公司,美國);腦立體定位儀(Stoelting 公司,美國)。
1.2 BMSCs 分離培養、鑒定及標記
取 1 只 SD 大鼠頸椎脫臼法處死,消毒后于超凈工作臺內取其雙側股骨及脛骨骨髓,分裝于數個含有完全培養基(含 10%FBS、100 U/mL 青霉素、100 μg/mL 鏈霉素的 DMEM/F-12 培養基)的 25 cm2塑料培養瓶中,37℃、5%CO2及飽和濕度培養箱中培養,每 3 天全量更換完全培養基 1 次,待細胞鋪滿培養瓶底 80%~90% 時,用 0.25% 胰蛋白酶-0.02%EDTA 按 1∶2 比例傳代;傳至第 3 代時用 FITC 標記的抗小鼠/大鼠 CD29 抗體和 PE 標記的抗大鼠 CD45RA 抗體在流式細胞儀上進行鑒定。
取第 3 代 BMSCs,于培養瓶中加入 100 μL 無菌抽濾的 0.5 mmol/L BrdU-PBS 液,使培養基中 BrdU 終濃度約為 10 μmol/L,置于 37℃、5%CO2及飽和濕度培養箱中培養,備用。
1.3 殼聚糖多孔支架的制備及觀測
1.3.1 殼聚糖多孔支架制備
將 2 g 殼聚糖溶于 100 mL 1% 乙酸溶液中,采用冷凍干燥法[13]制備殼聚糖多孔支架。
1.3.2 殼聚糖多孔支架孔隙率檢測
將經滅菌處理的殼聚糖多孔支架移入超凈臺中,用經高壓蒸氣滅菌的 0.01 mol/L PBS 緩沖液(pH7.2)清洗 3 次,每次 10 min;再用完全培養基清洗 2 次,每次 10 min,吸去清洗液后重新加入完全培養基浸泡 24 h。用乙醇替代法[14]檢測其孔隙率,并在掃描電鏡下觀察其內部結構。
1.3.3 MTT 法檢測 BMSCs 在殼聚糖多孔支架內生長情況
取經 BrdU 標記的第 3 代 BMSCs,以密度 1×104 個/孔分別接種于放置于 96 孔培養板中的殼聚糖多孔支架上(實驗組)和不含殼聚糖支架的 96 孔培養板孔內(對照組),均加入 200 μL 完全培養基,37℃、5%CO2及飽和濕度培養箱中培養。分別于培養 1、2、4、7、10、13 d 每組隨機取 3 孔,每孔加入 20 μL 5 mg/mL MTT,置于培養箱培養 4 h;棄培養液,加入 DMSO 150 μL,震蕩 15 min,用酶聯免疫檢測儀于波長 570 nm 處檢測吸光度(A)值。
1.3.4 支架-細胞體外共培養掃描電鏡觀察
取經 BrdU 標記的第 3 代 BMSCs,以 1×106 個/mL 密度接種于置于 24 孔培養板孔內經滅菌處理的殼聚糖多孔支架上,置于 37℃、5%CO2及飽和濕度培養箱共培養 48 h 后,掃描電鏡下觀察。
1.4 大鼠 TBI 修復實驗
1.4.1 實驗分組及方法
取 50 只 SD 大鼠,采用隨機數字表法分為 5 組,每組 10 只。A 組為 BMSCs -殼聚糖多孔支架移植組,B 組為 BMSCs 移植組,C 組為殼聚糖多孔支架移植組,D 組為損傷對照組,E 組為假手術組。
TBI 造模方法:將 A~D 組大鼠用 10% 水合氯醛腹腔注射麻醉后固定于腦立體定位儀上,頭皮剪毛后常規消毒;沿大鼠頭頂矢狀位中線切開頭皮(切口約長 1 cm),向兩側分離以暴露前囟、矢狀縫和冠狀縫,以冠狀縫后 1.5 mm、矢狀縫左旁 2.5 mm 為中心,用牙科磨鉆鉆一直徑 5 mm 的圓形骨窗,保持硬腦膜完整;在骨窗上方垂直固定改良的 Feeney 自由落體打擊裝置,以 500 g·cm 的致傷力造成大鼠左側皮質局限性創傷;打擊后立即移開打擊裝置,如大鼠出現短暫的四肢抽搐、呼吸暫停數秒,提示 TBI 模型制備成功。然后清創止血、縫合頭皮,待動物清醒后分籠飼養。術后青霉素 10 萬 U 肌肉注射。E 組大鼠同上法麻醉后,僅切開頭皮和顱骨開窗,不制備 TBI模型,作為假手術組。
大鼠造模后 72 h 使用 10% 水合氯醛腹腔注射麻醉,俯臥位固定于腦立體定位儀上,消毒手術切口后拆線。各組大鼠清創后,A、B、C 組分別取共培養 48 h 的 BrdU 標記 BMSCs-殼聚糖多孔支架復合體、體外培養 48 h 的 BrdU 標記 BMSCs、體外培養 48 h 的殼聚糖多孔支架移植于腦創傷區,D 組于腦創傷區注射等量完全培養基,E 組大鼠直接縫合頭皮。各組大鼠于細胞移植前 12 h 及移植后 1~5 d 每天尾靜脈注射環孢素 1 次,縫合頭皮后均肌肉注射青霉素 10 萬 U。
1.4.2 改良神經功能缺損評分(modified neurological severity scores,mNSS)
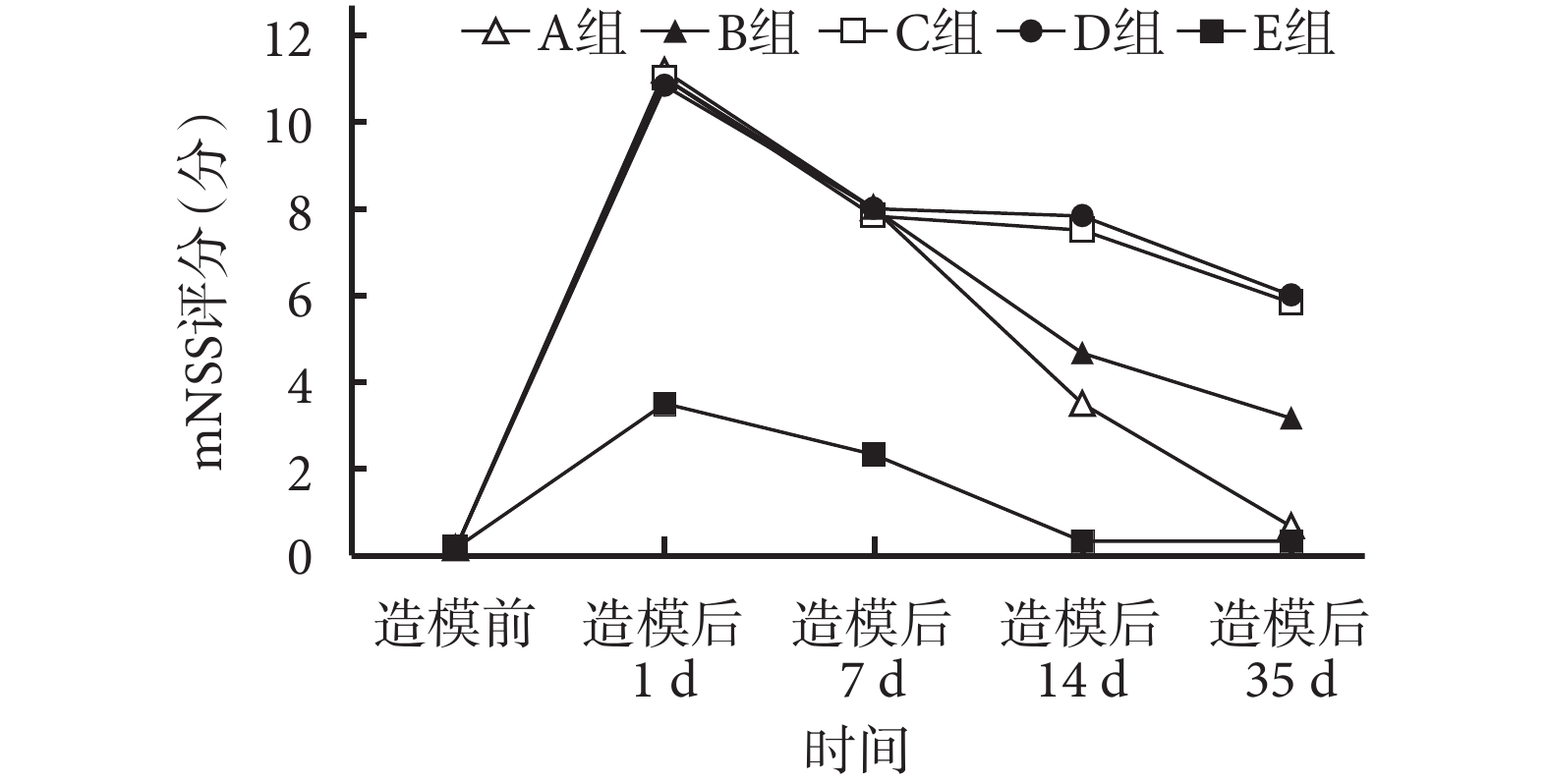
分別于造模前及造模后 1、7、14、35 d,對各組大鼠行 mNSS 評分[5],評估大鼠 TBI 后的神經功能修復情況。
1.4.3 Morris 水迷宮測驗
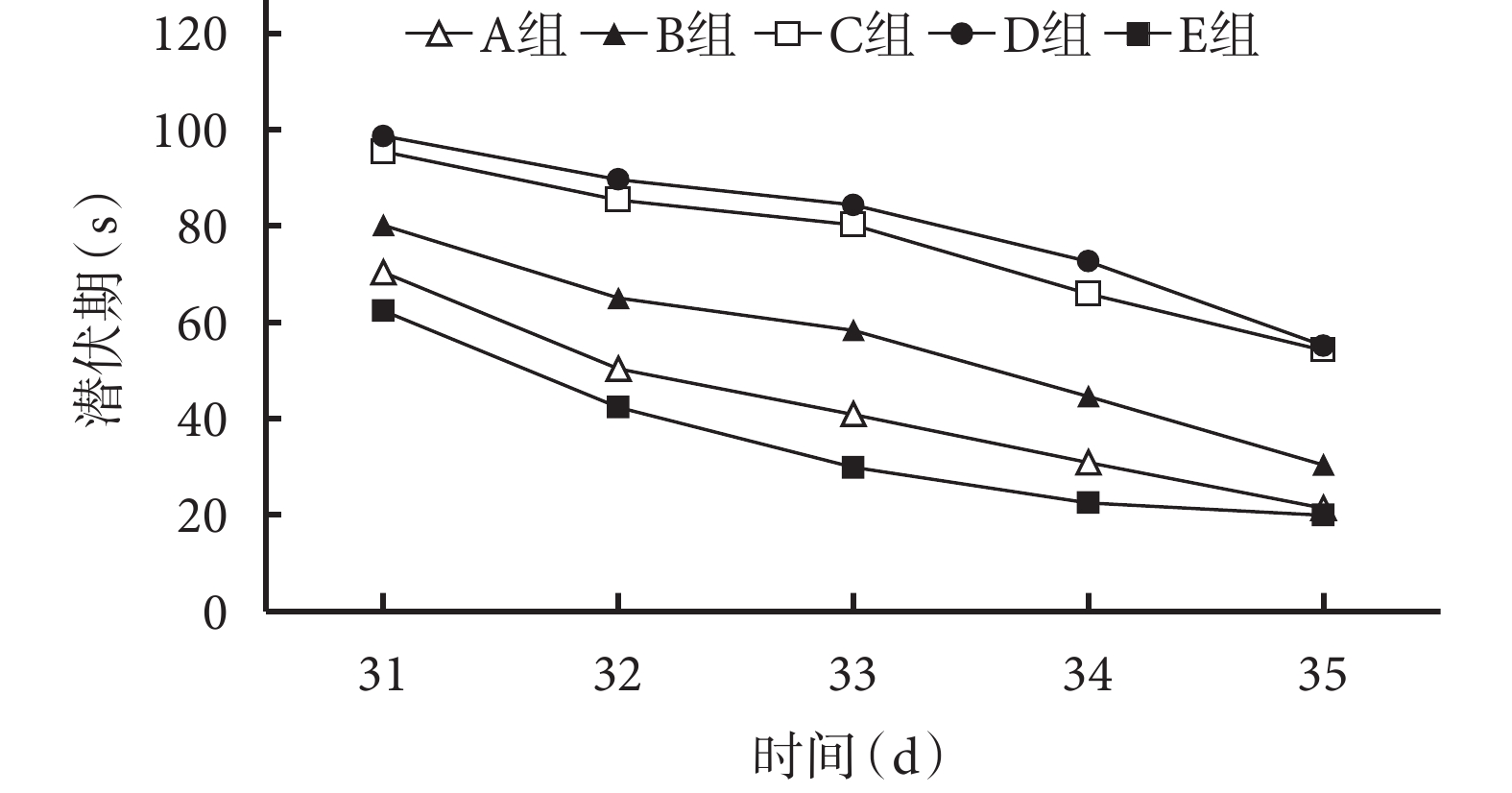
造模后對各組大鼠進行 Morris 水迷宮測驗,包括定位航行測驗(造模后 31~35 d 連續 5 d 檢測潛伏期)及空間探索測驗(造模后 35 d 檢測穿越平臺次數)。
1.4.4 HE 染色
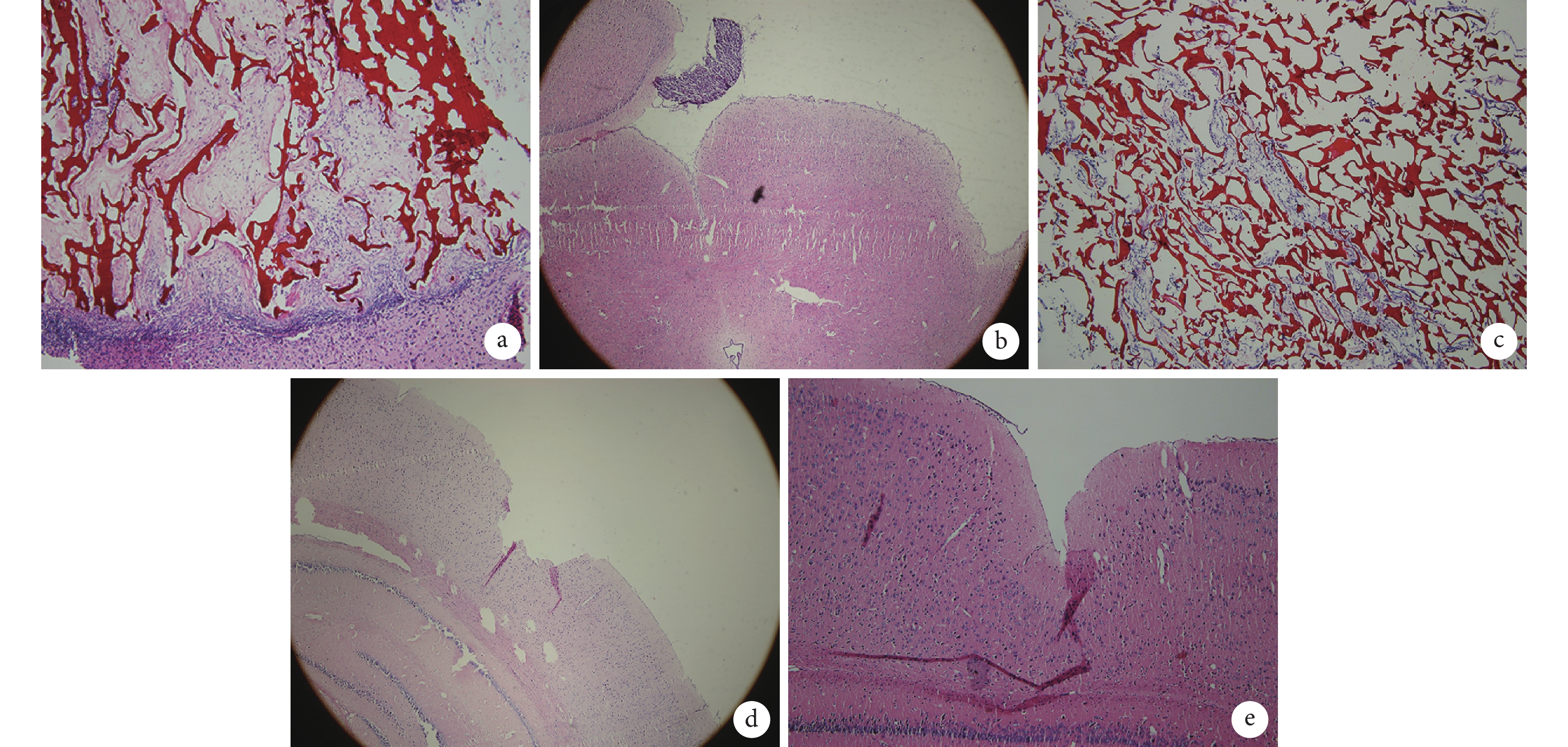
造模后 36 d 所有大鼠行斷頭取腦,石蠟包埋、切片,取部分切片行 HE 染色觀察。
1.4.5 免疫組織化學雙重染色
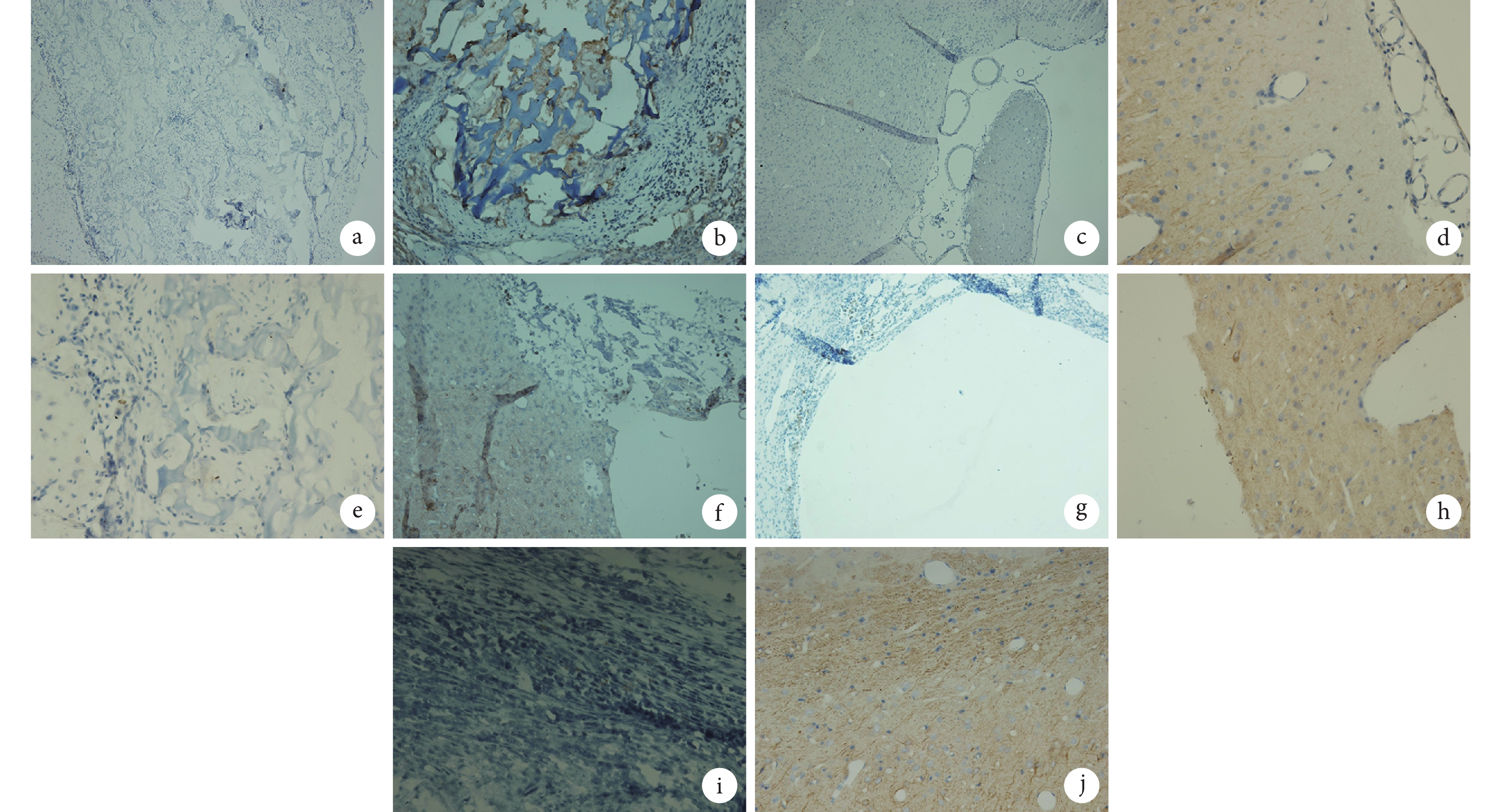
造模后 36 d 取上述部分石蠟切片進行免疫組織化學染色,酶聯免疫檢測儀下觀察。① BrdU 和 GFAP 雙重染色方法:取相鄰腦組織切片中的 1 片,常規脫蠟至水,抗原修復,加兔血清封閉 1 h,滴加約 50 μL 綿羊抗 BrdU 一抗工作液(1∶130),4℃ 過夜;再滴加約 50 μL 辣根過氧化物酶標記的兔抗綿羊二抗工作液(1∶500),顯色后蘇木素復染,封片。再取相鄰腦組織切片中的另 1 片,常規脫蠟至水,抗原修復,加山羊血清封閉 1 h,滴加約 50 μL 小鼠抗 GFAP 一抗工作液(1∶50),4℃ 過夜;再滴加約 50 μL 辣根過氧化物酶標記的山羊抗小鼠二抗工作液(1∶500),顯色后蘇木素復染,封片。② BrdU 和 NF-H 雙重染色方法:取相鄰腦組織切片中的 1 片,常規脫蠟至水,抗原修復,加兔血清封閉 1 h,滴加約 50 μL 綿羊抗 BrdU 一抗工作液(1∶130),4℃ 過夜,再滴加約 50 μL 辣根過氧化物酶標記的兔抗綿羊二抗工作液(1∶500),顯色后蘇木素復染,封片。再取相鄰腦組織切片中的另 1 片,常規脫蠟至水,抗原修復,加山羊血清封閉 1 h,滴加約 50 μL 小鼠抗 NF-H 一抗工作液(1∶200),4℃ 過夜,滴加約 50 μL 辣根過氧化物酶標記的山羊抗小鼠二抗工作液(1∶500),顯色后蘇木素復染,封片。
1.5 統計學方法
采用 SPSS13.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;組內各時間點間比較采用重復測量方差分析,兩兩比較采用配對t檢驗;檢驗水準 α=0.05。
2 結果
2.1 BMSCs 鑒定
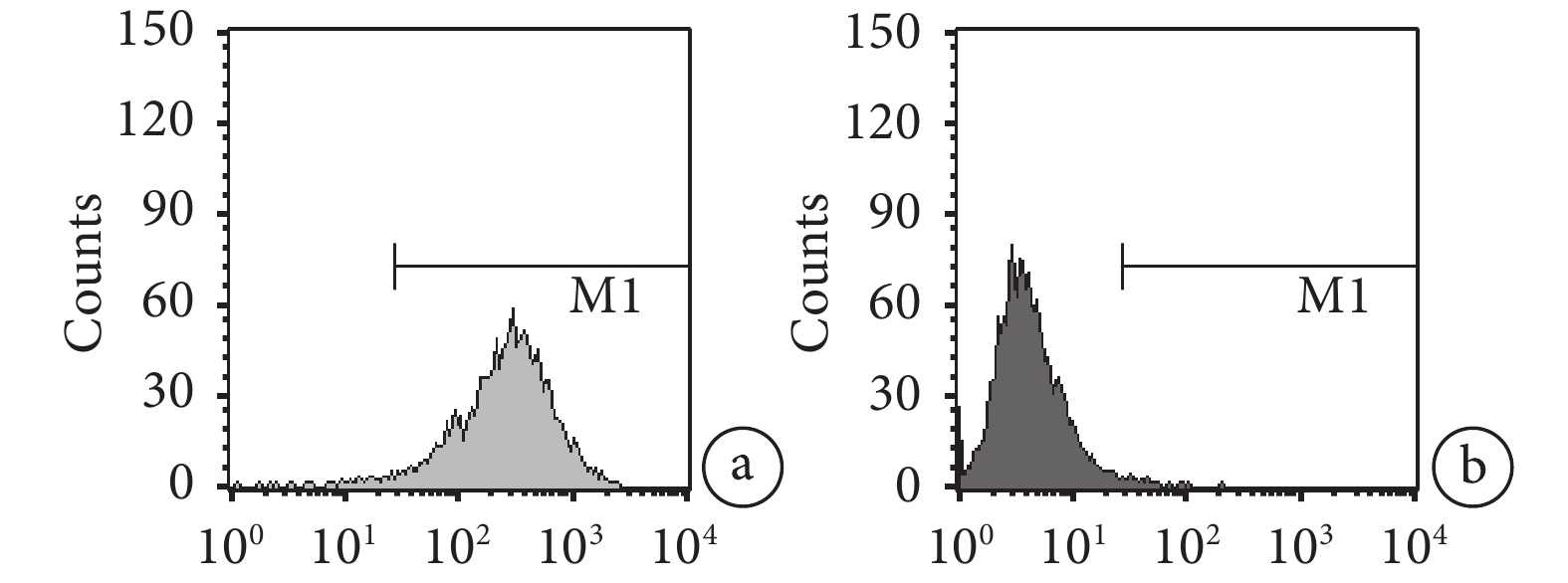
流式細胞儀檢測示,采用全骨髓貼壁法培養傳至第 3 代的 BMSCs,CD29 陽性率為 98.49%,CD45 陽性率僅為 0.85%。見圖 1。
2.2 殼聚糖多孔支架相關觀測
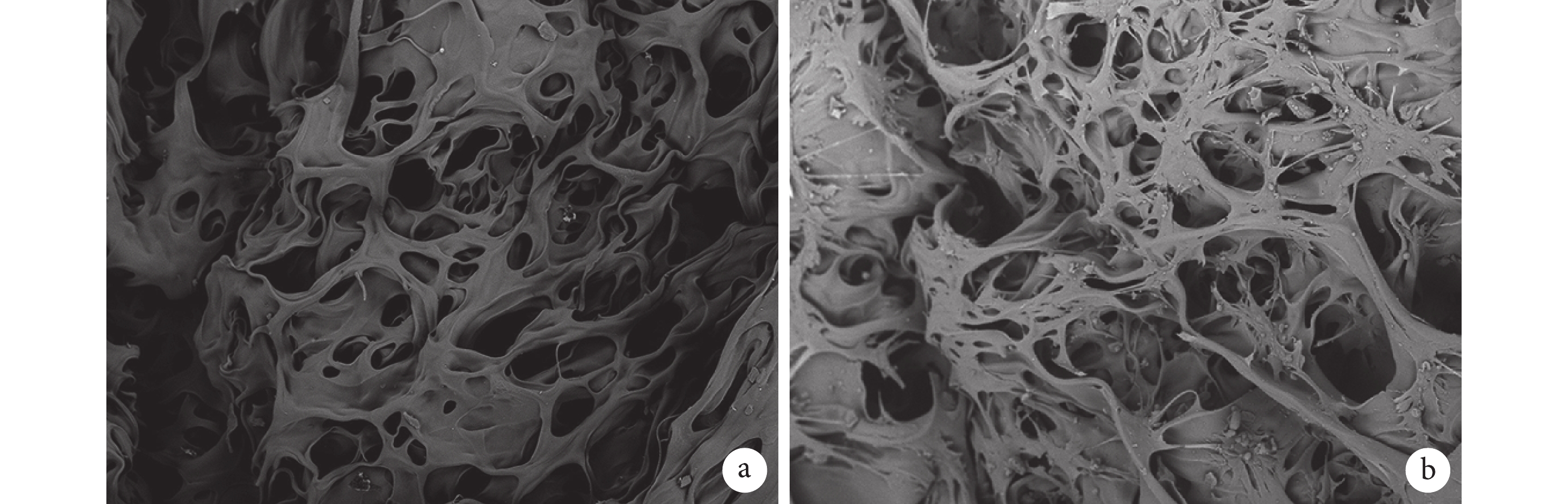
乙醇替代法檢測殼聚糖多孔支架的孔隙率為 90.0%±0.5%。掃描電鏡可見支架橫斷面內部密布大小相對均一的孔洞,孔相通性較好,孔徑為 80~200 μm,平均 140 μm。支架-細胞復合培養 48 h 掃描電鏡觀察示,BMSCs 廣泛分布于殼聚糖多孔支架表面及孔內,細胞呈梭形并分泌細胞外基質黏附于支架上,其在三維培養環境下生長良好。見圖 2。
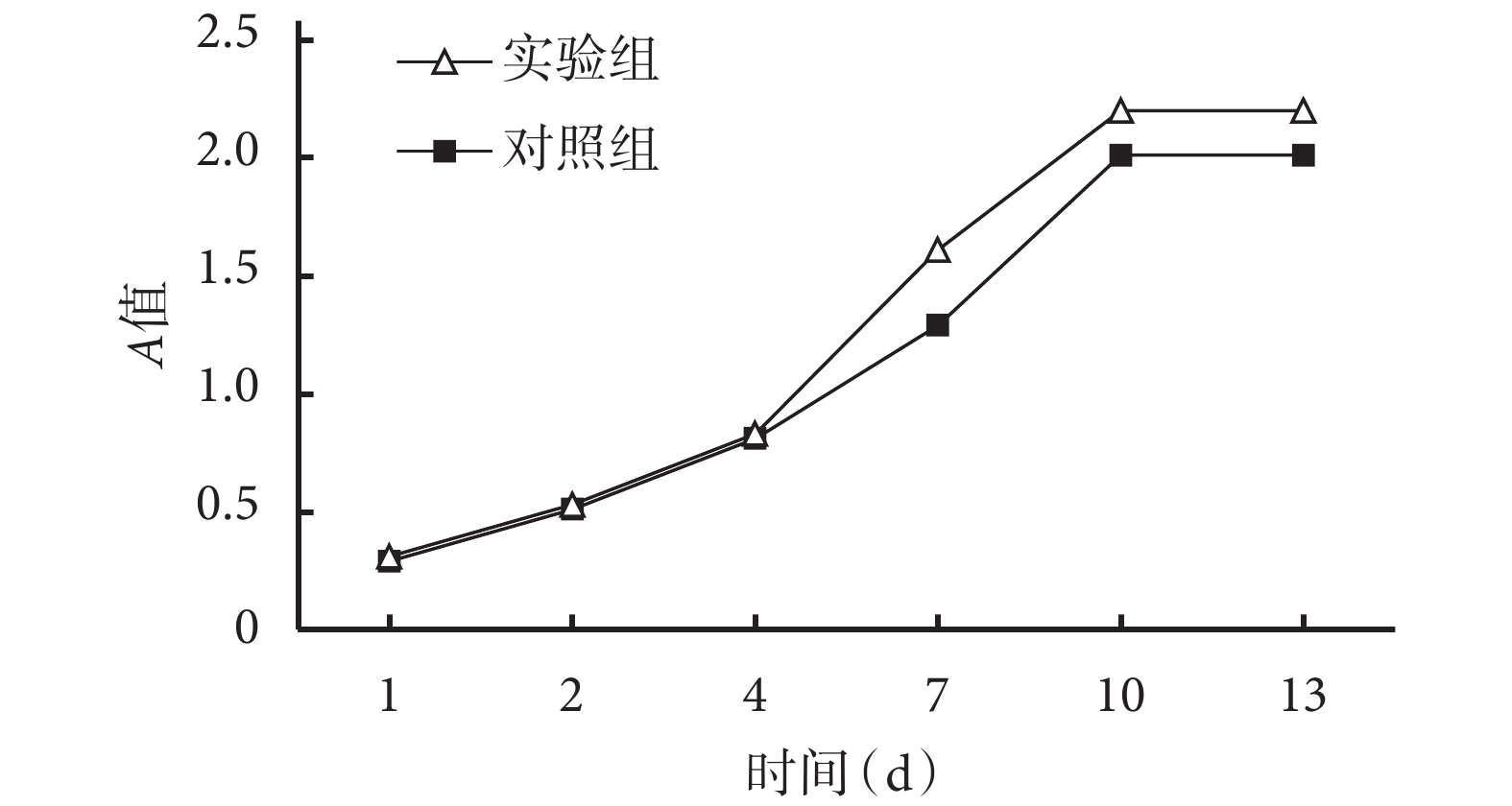
MTT 法檢測示,兩組細胞生長曲線趨勢相似,復合培養 1、2 d 為生長潛伏期,4、7 d 進入快速增長期,10~13 d 為平臺期。培養 7、10、13 d 時實驗組 A 值顯著高于對照組,差異有統計學意義(P<0.05)。見圖 3。
2.3 大鼠 TBI 修復實驗
2.3.1 mNSS 評分
造模后 1 d 各組 mNSS 評分均達峰值,隨時間延長呈下降趨勢。造模后 1 d A~D 組 mNSS 評分均顯著高于 E 組,差異有統計學意義(P<0.05);A~D 組間差異無統計學意義(P>0.05)。造模后 35 d A、E 組 mNSS 評分顯著低于 B、C、D 組,B 組低于 C、D 組,比較差異均有統計學意義(P<0.05);A、E 組間及 C、D 組間比較差異無統計學意義(P>0.05))。見圖 4。
2.3.2 Morris 水迷宮測試
定位航行測驗結果顯示,造模后 31~35 d,各組潛伏期均逐漸下降。各時間點 A、E 組潛伏期均顯著低于 B、C、D 組,B 組低于 C、D 組,比較差異均有統計學意義(P<0.05);A、E 組間及 C、D 組間比較差異無統計學意義(P>0.05)。見圖 5。
空間探索測驗結果示,造模后 35 d A~E 組穿越平臺次數分別為(9.580±1.281)、(6.080±0.736)、(3.250±0.689)、(1.667±0.753)、(9.750±1.129)次,A、E 組顯著高于 B、C、D 組,B 組高于 C、D 組,C 組高于 D 組,差異均有統計學意義(P<0.05);A、E 組間比較差異無統計學意義(P>0.05)。
2.3.3 HE 染色觀察
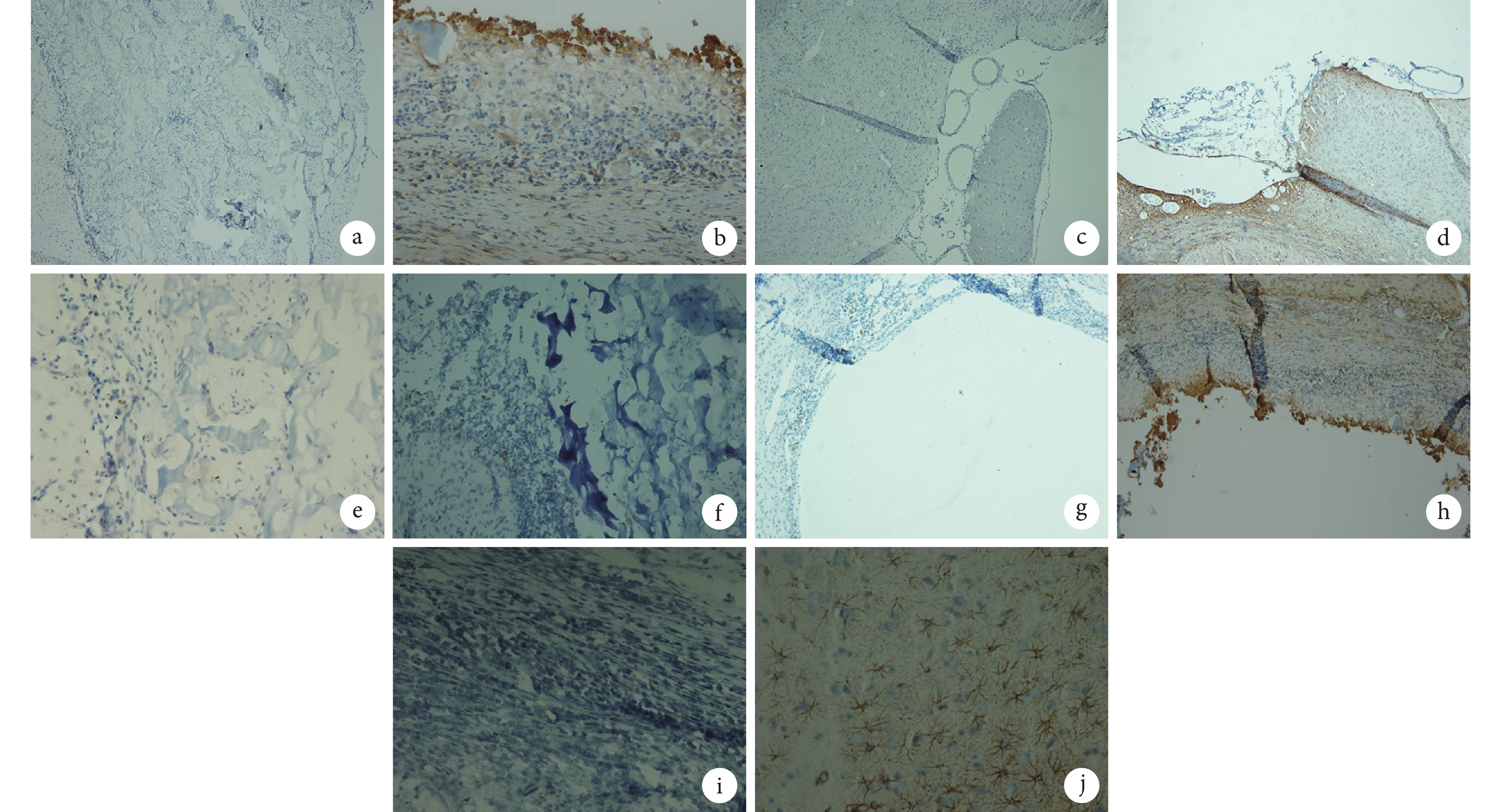
造模后 36 d HE 染色示:A 組可見皮層損傷區內殼聚糖多孔支架(磚紅色)結構,內有細胞填充,亦可見在損傷灶底層有正常腦組織長入,殼聚糖多孔支架已部分降解;B 組在損傷區可見細胞團,與正常腦組織融合不緊密;C 組腦損傷區可見殼聚糖多孔支架,其內有少量細胞長入;D 組左側腦皮層可見明顯的損傷灶缺損;E 組大鼠未見腦損傷區。見圖 6。
2.3.4 免疫組織化學雙重染色觀察
BrdU 與 NF-H 雙重染色法以及 BrdU 與 GFAP 雙重染色法結果示,造模后 36 d A 組大鼠 BrdU 標記的 BMSCs 仍然存活并且能分化為神經元和神經膠質細胞,部分分化的神經細胞已遷移至損傷區周圍,甚至進入正常腦組織內,而部分正常腦組織細胞也長入移植復合體內;B 組大鼠腦損傷區可見與正常腦組織融合不緊密的細胞團,而其損傷區周圍正常的腦組織內亦可見散在分布的 BMSCs 來源的神經元和神經膠質細胞;C 組大鼠腦損傷區可見殼聚糖多孔支架,支架內有細胞附著,但未發現 BMSCs 來源的神經元和神經膠質細胞;D 組大鼠腦損傷區無明顯改變;E 組大鼠無腦損傷區。見圖 7、8。
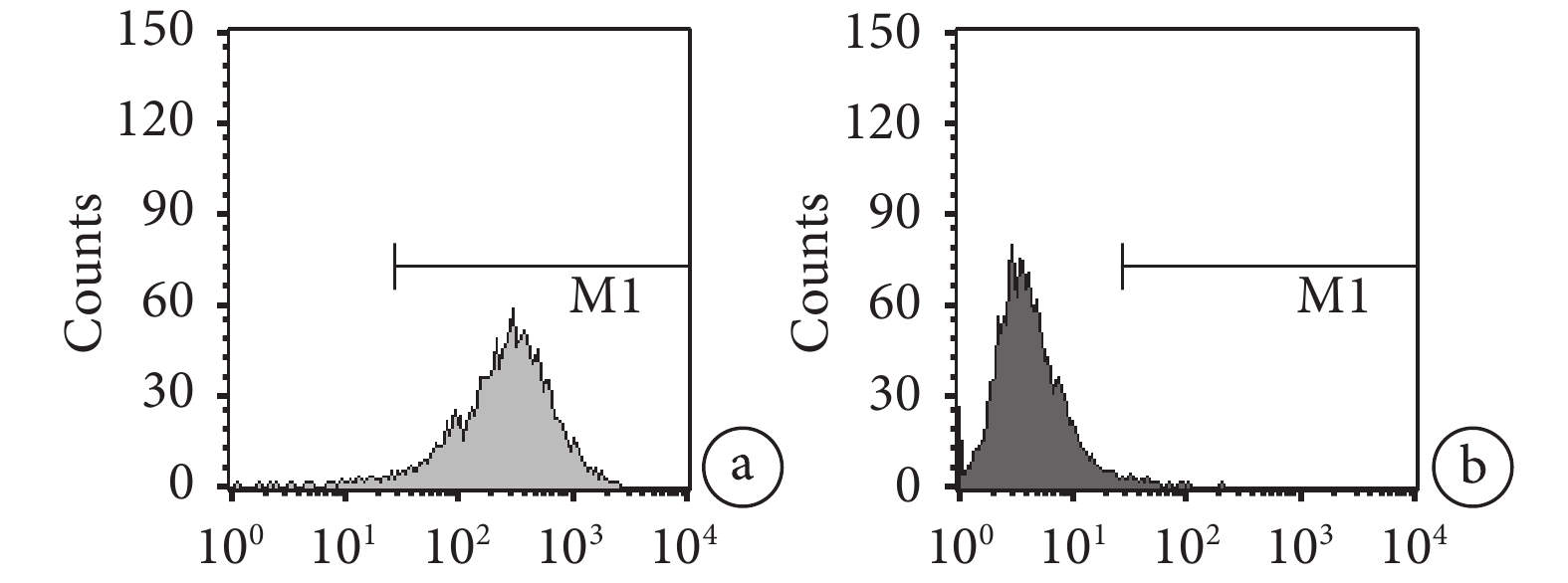 圖1
第 3 代 BMSCs 流式細胞儀檢測
圖1
第 3 代 BMSCs 流式細胞儀檢測
a. CD29;b. CD45
Figure1. Flow cytometry detection of the 3rd generation BMSCsa. CD29; b. CD45
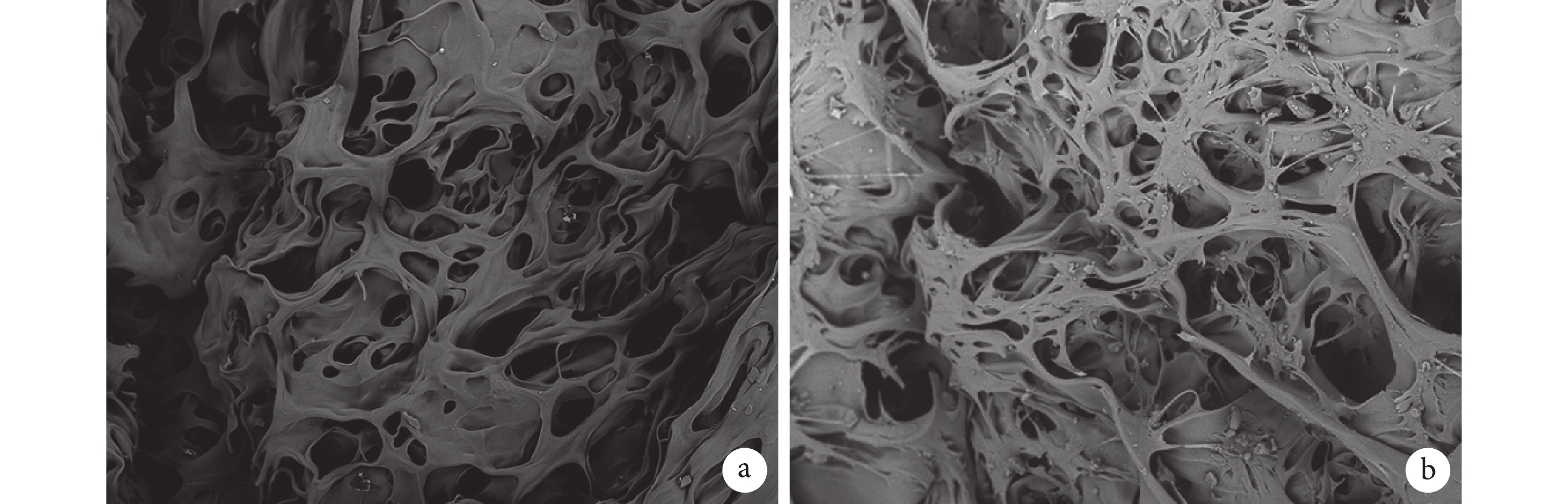 圖2
掃描電鏡觀察(×200)
圖2
掃描電鏡觀察(×200)
a. 殼聚糖多孔支架;b. 支架-細胞復合培養 2 d
Figure2. Scanning electron microscope observation (×200)a. Chitosan porous scaffold; b. Scaffold-cell co-cultured for 2 days
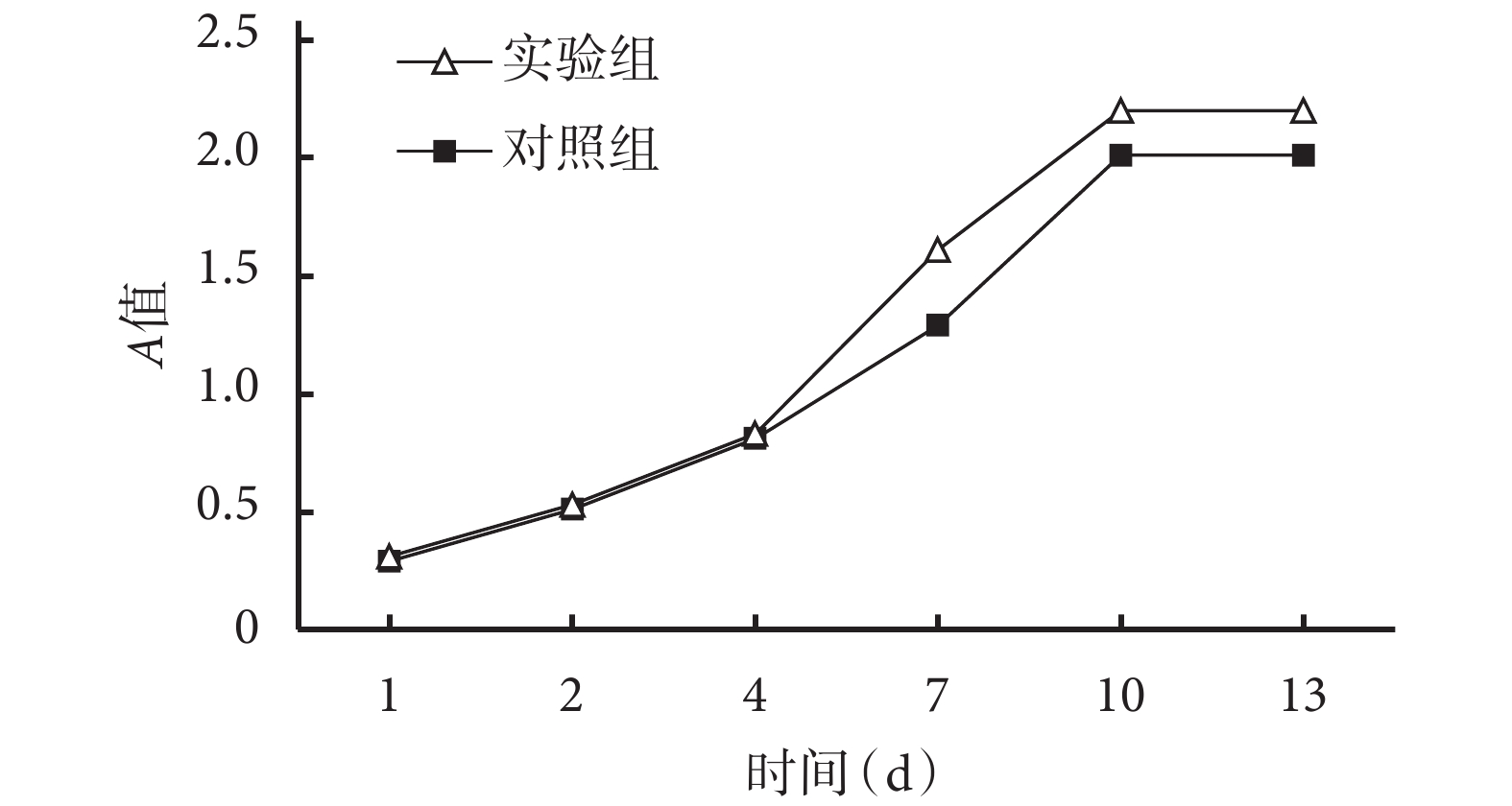 圖3
MTT 法檢測 BMSCs 在支架材料中的生長曲線
Figure3.
Growth curve of BMSCs in scaffolds by MTT assay
圖3
MTT 法檢測 BMSCs 在支架材料中的生長曲線
Figure3.
Growth curve of BMSCs in scaffolds by MTT assay
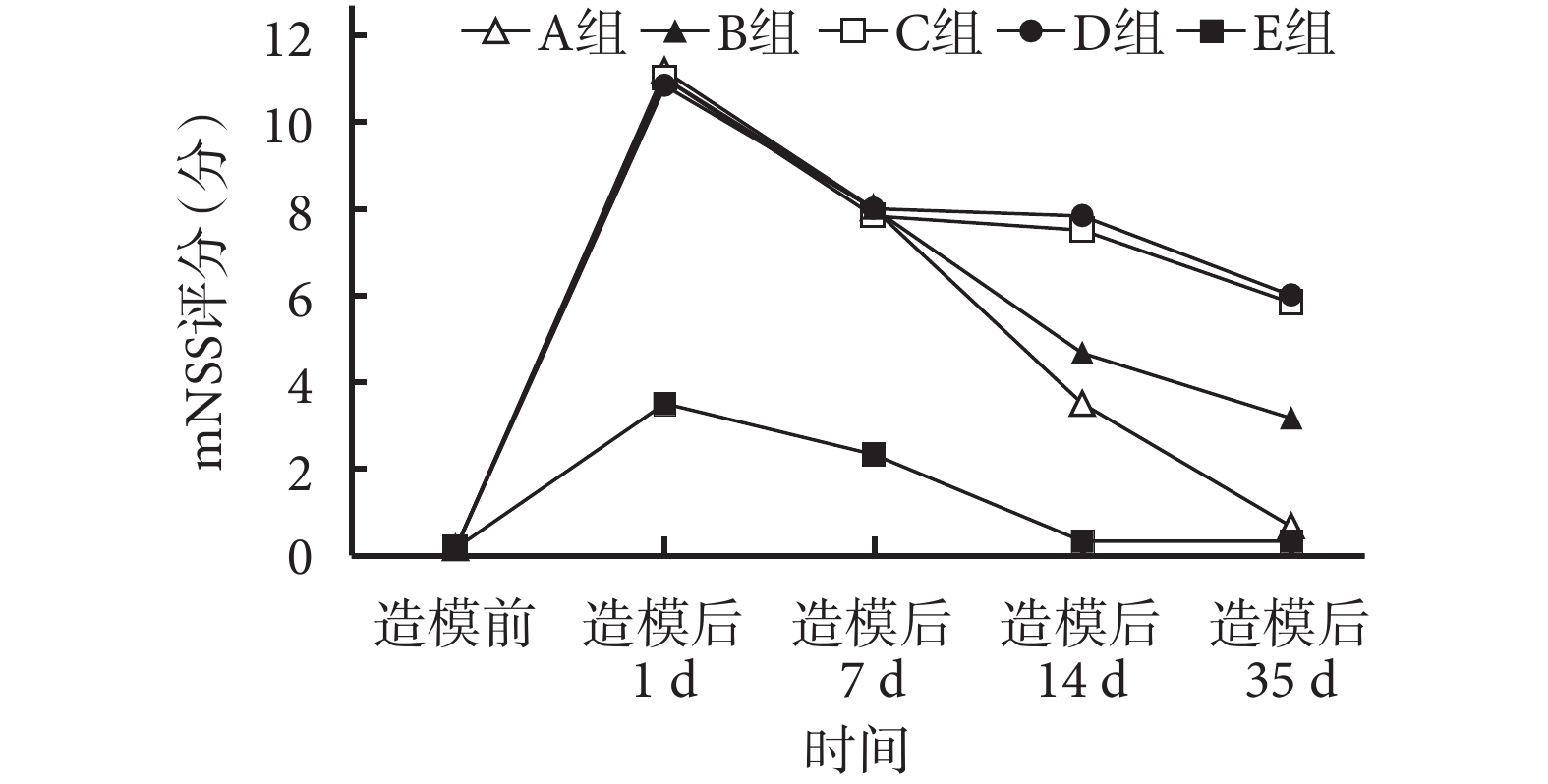 圖4
各時間點各組大鼠 mNSS 評分比較
Figure4.
Comparison of mNSS scores of rats in each group at different time points
圖4
各時間點各組大鼠 mNSS 評分比較
Figure4.
Comparison of mNSS scores of rats in each group at different time points
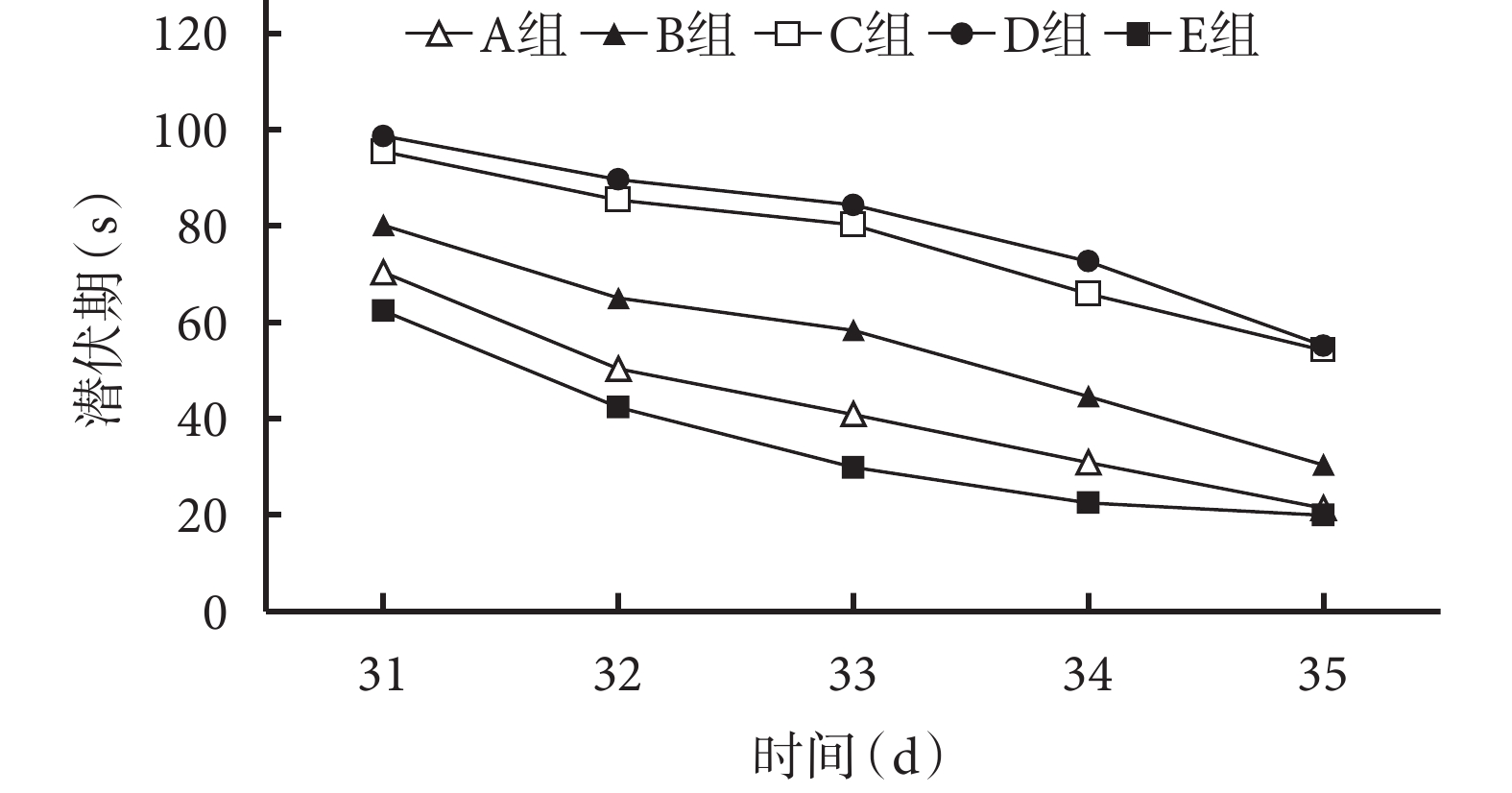 圖5
各時間點各組大鼠定位航行測驗潛伏期
Figure5.
Positioning voyage test’s incubation period of rats in each group at different time points
圖5
各時間點各組大鼠定位航行測驗潛伏期
Figure5.
Positioning voyage test’s incubation period of rats in each group at different time points
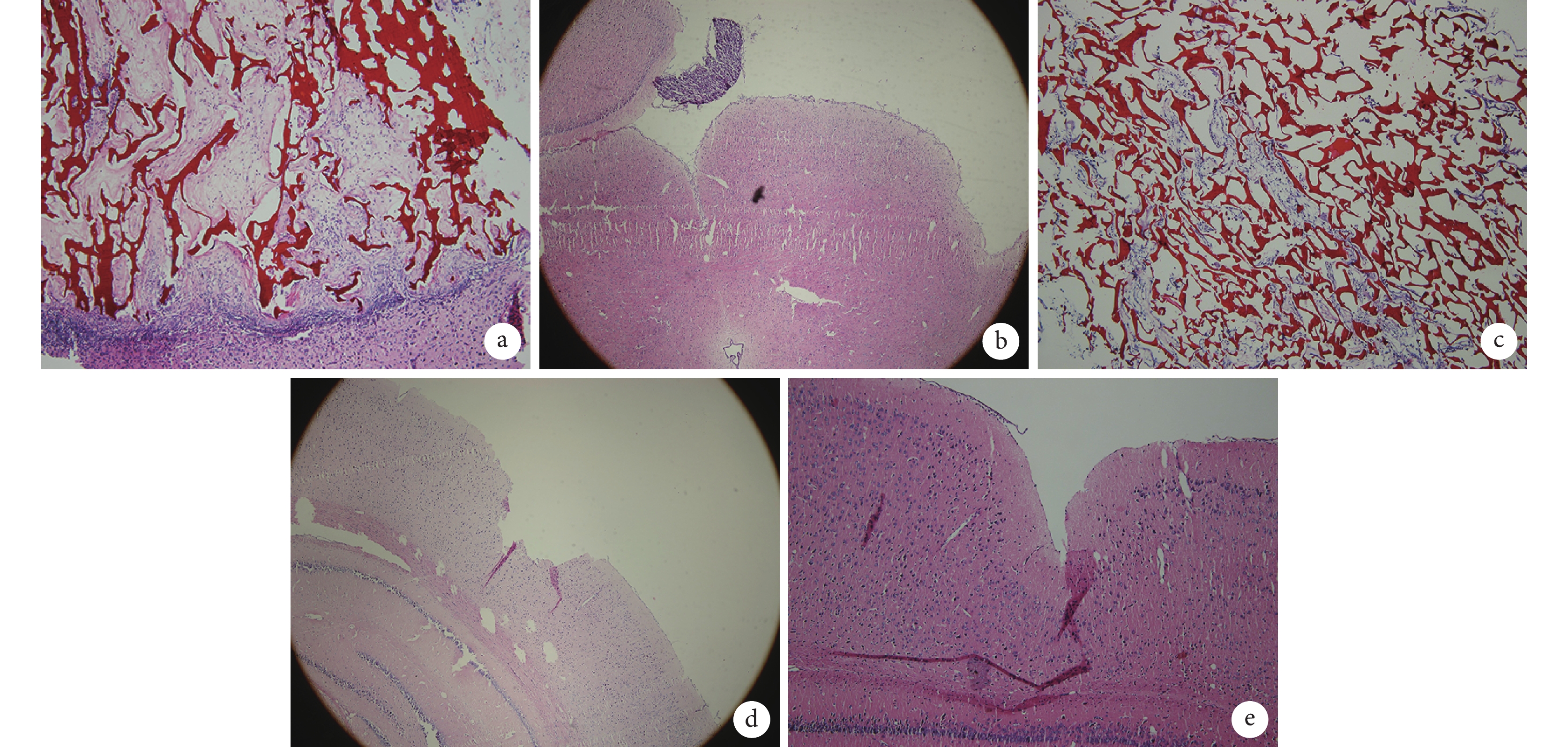 圖6
造模后 36 d 各組大鼠 HE 染色觀察
圖6
造模后 36 d 各組大鼠 HE 染色觀察
a. A 組(×10);b. B 組(×4);c. C 組(×10);d. D 組(×4);e. E 組(×40)
Figure6. HE staining observation of rats in each group at 36 days after TBIa. Group A (×10); b. Group B (×4); c. Group C (×10); d. Group D (×4); e. Group E (×40)
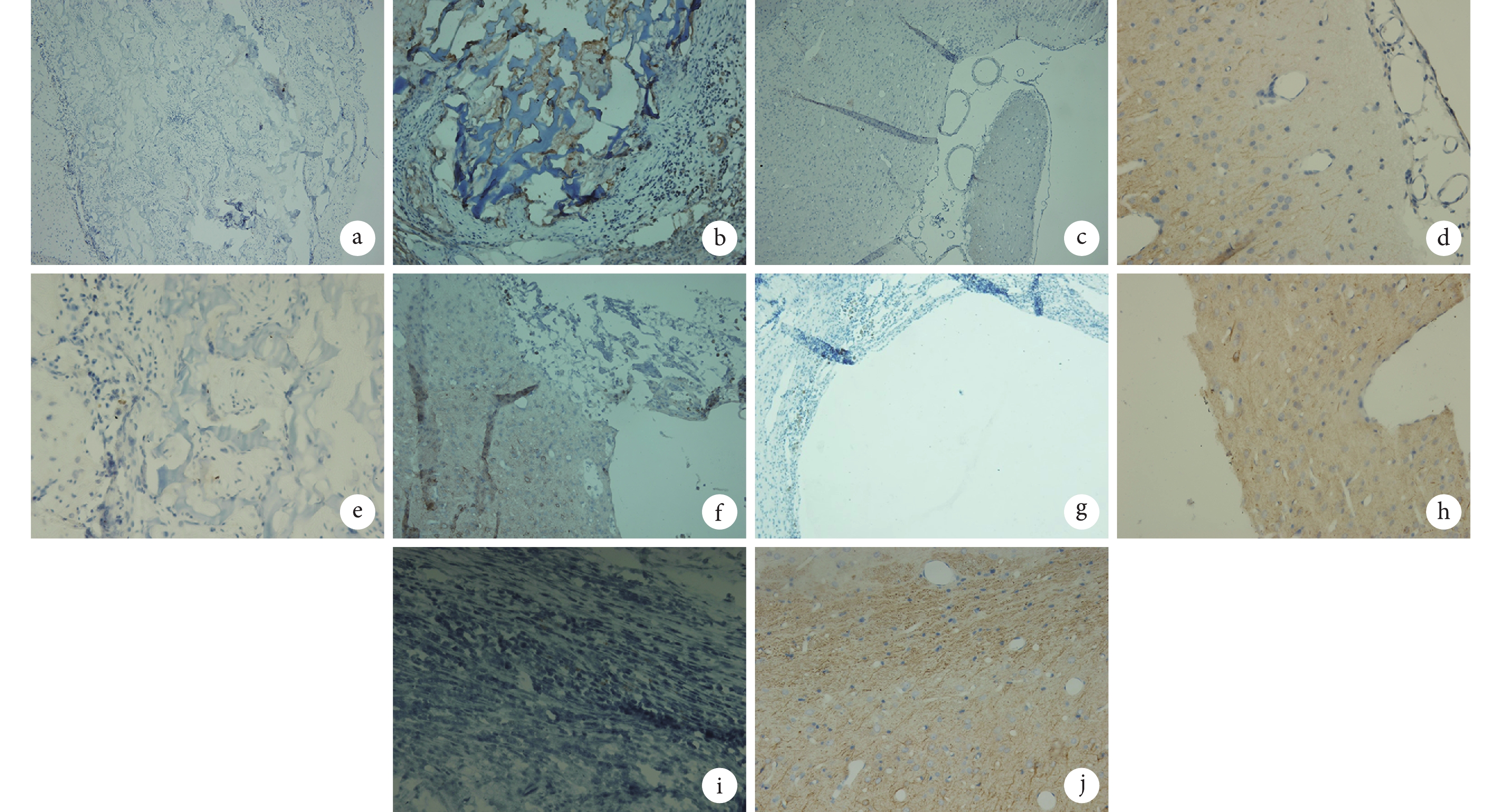 圖7
造模后 36 d 各組大鼠 BrdU 與 NF-H 雙重染色觀察
圖7
造模后 36 d 各組大鼠 BrdU 與 NF-H 雙重染色觀察
a. A 組 BrdU 染色(×10);b. A 組 NF-H 染色(×20);c. B 組 BrdU 染色(×10);d. B 組 NF-H 染色(×40);e. C 組 BrdU 染色(×40);f. C 組 NF-H 染色(×20);g. D 組 BrdU 染色(×10);h. D 組 NF-H 染色(×40);i. E 組 BrdU 染色(×40);j. E 組 NF-H 染色(×40)
Figure7. BrdU and NF-H immunohistochemistry double staining observation of rats in each group at 36 days after TBIa. BrdU staining of group A (×10); b. NF-H staining of group A (×20); c. BrdU staining of group B (×10); d. NF-H staining of group B (×40); e. BrdU staining of group C (×40); f. NF-H staining of group C (×20); g. BrdU staining of group D (×10); h. NF-H staining of group D (×40); i. BrdU staining of group E (×40); j. NF-H staining of group E (×40)
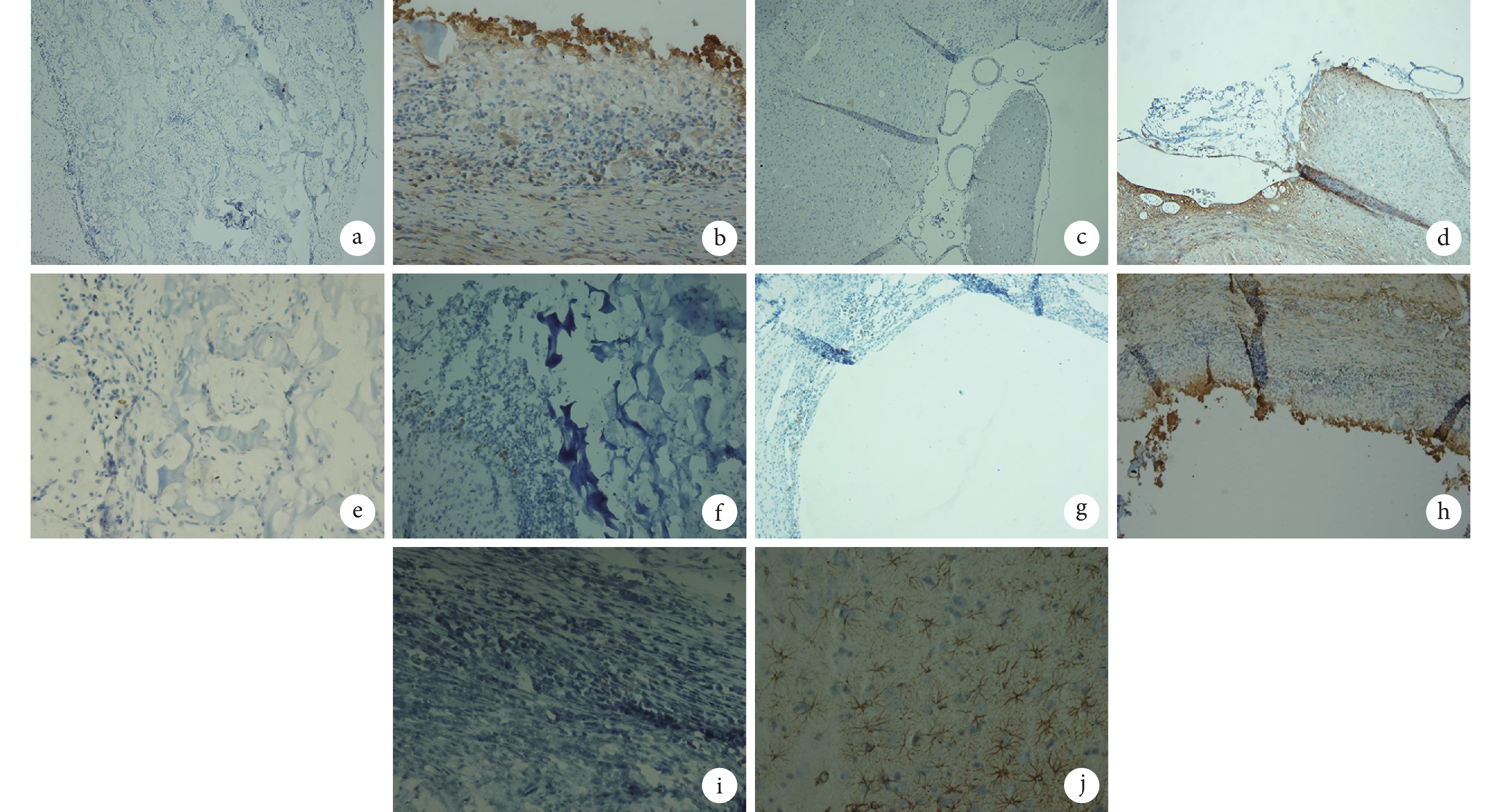 圖8
造模后 36 d 各組大鼠 BrdU 與 GFAP 雙重染色觀察
圖8
造模后 36 d 各組大鼠 BrdU 與 GFAP 雙重染色觀察
a. A 組 BrdU 染色(×10);b. A 組 GFAP 染色(×40);c. B 組 BrdU 染色(×10);d. B 組 GFAP 染色(×10);e. C 組 BrdU 染色(×40);f. C 組 GFAP 染色(×20);g. D 組 BrdU 染色(×10);h. D 組 GFAP 染色(×10);i. E 組 BrdU 染色(×40);j. E 組 GFAP 染色(×40)
Figure8. BrdU and GFAP immunohistochemistry double staining observation of rats in each group at 36 days after TBIa. BrdU staining of group A (×10); b. GFAP staining of group A (×40); c. BrdU staining of group B (×10); d. GFAP staining of group B (×10); e. BrdU staining of group C (×40); f. GFAP staining of group C (×20); g. BrdU staining of group D (×10); h. GFAP staining of group D (×10); i. BrdU staining of group E (×40); j. GFAP staining of group E (×40)
3 討論
組織工程學的原理是將體外分離、培養并擴增的細胞,黏附于一種生物相容性好、能在體內降解的生物材料所制支架上,從而形成細胞-支架復合體,再將其植入機體組織或器官損傷區,支架在機體內逐漸降解吸收的過程中,其內黏附的細胞能形成新的組織或器官并具有相應的形態和功能,進而達到修復機體創傷和恢復機體功能的目的。生物材料支架所形成的三維結構能夠為細胞提供獲取營養和生長代謝的場所,生物材料支架的形狀直接影響黏附細胞的生長、增殖、遷移等活動。本實驗利用冷凍干燥法制備的殼聚糖多孔支架孔隙率為 90.0%±0.5%、孔徑為 80~200 μm,孔隙相對均勻、連通性好;且冷凍干燥法能避免高溫對支架表面生物活性分子的破壞。
TBI 的致死率和致殘率均較高[15]。腦損傷機制為腦創傷局部首先發生彌漫性的細胞壞死,接著發生細胞凋亡(繼發性損傷),最后星形膠質細胞激活形成膠質瘢痕[16]。通過靜脈輸注自體骨髓單核細胞可用于治療成人 TBI[17];但腦組織的自我修復能力有限,臨床上腦損傷的后期治療主要采用營養神經藥物配合功能訓練,療效不確切,很難達到修復受損神經元、重新建立突觸聯系,進而恢復神經功能的目的。
干細胞在局部微環境刺激下能增殖、分化為損傷區缺失的細胞,可起到細胞替代治療作用。作為組織工程的種子細胞,BMSCs 在細胞替代治療、基因治療以及組織器官的再造中具有重要的研究意義及臨床應用價值,被廣泛應用于組織工程研究中[18]。本實驗通過掃描電鏡和 MTT 檢測發現,BMSCs 在三維培養環境下生長良好,BMSCs 與殼聚糖多孔支架具有良好的生物相容性。
TBI 后 24 h 內,腦損傷區會產生大量細胞因子或毒素,如氧自由基、炎性細胞因子等,不利于移植細胞的存活[19];而在 TBI 后 72 h 左右,損傷區邊緣清晰、可形成壞死灶利于清創,更利于移植細胞的存活。因此,本研究于造模后 72 h 進行移植。移植細胞的長期存活并增殖分化為受損細胞是移植治療的關鍵,腦損傷后往往會有膠質瘢痕形成,進而阻止再生軸突進入損傷區與正常神經細胞形成突觸聯系,因此在損傷區重建組織結構以利于神經細胞再生很有必要。本實驗根據組織工程學原理進行殼聚糖多孔支架介導的 BMSCs 移植治療大鼠 TBI,HE 染色結果顯示移植后 A 組大鼠腦內移植復合體與損傷區周圍腦組織整合,移植物內存有較多細胞,與移植前相比,殼聚糖多孔支架已發生了部分降解。BrdU 與 NF-H 雙重染色以及 BrdU 與 GFAP 雙重染色結果表明,移植后 BrdU 標記的 BMSCs 存活并且能分化為神經元和神經膠質細胞,部分分化的神經細胞已遷移至損傷區周圍甚至進入正常腦組織內,而部分正常腦組織細胞也長入移植復合體內,再次表明 A 組大鼠腦內移植復合體與損傷區周圍腦組織整合。
大鼠 TBI 后會發生認知功能障礙和神經功能缺損[20],本實驗 mNSS 評分和 Morris 水迷宮測驗結果進一步驗證了該觀點。在 TBI 后 35 d,A 組 mNSS 評分顯著低于 B、C、D 組(P<0.05),與 E 組比較 mNSS 評分差異無統計學意義(P>0.05);定位航行測驗示,造模后 31~35 d A、E 組潛伏期均顯著低于 B、C、D 組,B 組低于 C、D 組(P<0.05),而 A、E 組間及 C、D 組間比較差異無統計學意義(P>0.05);空間探索測驗示,造模后 35 d A、E 組穿越平臺次數顯著高于 B、C、D 組,B 組高于 C、D 組,C 組高于 D 組,組間差異均有統計學意義(P<0.05);A、E 組間比較差異無統計學意義(P>0.05)。大鼠 TBI 后采用 BMSCs 復合殼聚糖多孔支架移植治療能顯著提高大鼠的認知功能(空間學習與記憶能力),其治療效果明顯優于單純的 BMSCs 或殼聚糖多孔支架移植治療。
結合以往研究和本實驗結果,我們認為殼聚糖多孔支架介導的 BMSCs 移植治療大鼠 TBI 后,大鼠認知功能與神經功能缺損改善的機制可能包括:① 在腦表面局部應用的 BMSCs 能夠遷移至腦外傷區域[21],分化為神經元和神經膠質細胞,部分重建了損傷局部的神經回路,從而代償損傷細胞的部分功能;② BMSCs 能分泌腦源性神經營養因子、VEGF 等,促進血管新生,也能改善大腦局部微環境,減輕 TBI 后的繼發性神經功能損害,促進神經功能的恢復[22-23];③ 移植的 BMSCs 能夠刺激肺巨噬細胞并且增強脾臟對調節性 T 細胞的產生,導致循環系統抗炎細胞因子的增加和中樞神經系統局部環境的改變,從而起到神經保護作用[24];④ 移植復合體中的殼聚糖多孔支架能抑制膠質瘢痕形成,有利于移植復合體與正常腦組織間建立新的突觸聯系。
綜上述,殼聚糖多孔支架能為 BMSCs 提供三維結構的生長環境,BMSCs 能在腦局部微環境刺激下分化為神經細胞,并與正常腦組織建立聯系,從而促進 TBI 大鼠神經功能的修復。但如何控制 BMSCs 分化成神經元和神經膠質細胞的比例,使 BMSCs 分化成更多的神經元,仍需要進一步研究。
創傷性腦損傷(traumatic brain injury,TBI)是最常見的神經系統疾病之一,發病率呈逐年上升趨勢,其后遺癥嚴重影響患者生活質量,給家庭和社會造成極大的經濟負擔,已成為日益嚴重的公共衛生問題[1]。TBI 是中樞神經系統的一種進行性退行性病變,以細胞丟失為主要特征[2],TBI 后神經元的壞死、缺失、膠質瘢痕形成及神經環路中斷,可導致學習和記憶等功能障礙[3]。TBI 通過一種大腦修復和/或可塑機制來激活神經干細胞的增殖,但 TBI 后腦組織內部的神經干細胞增殖、遷移并分化為功能神經元的能力卻極為有限[4]。研究表明,神經干細胞腦內移植能夠促進損傷大鼠的神經行為和運動功能恢復,移植的神經干細胞能夠存活,向損傷灶遷移并分化為神經元[5]。但神經干細胞的研究和應用面臨倫理學限制。BMSCs 是從骨髓中分離培養而來的非造血干細胞,具有免疫原性低、抗纖維化和多向分化潛能,可分化為神經細胞、膠質細胞、脂肪細胞、成骨細胞及成軟骨細胞等,可充當多種器官改建或損傷后修復的細胞源[6-7]。有研究發現,在小鼠 TBI 后移植 BMSCs 能夠促進血管再生并改善神經功能[8]。生物材料可為移植的干細胞提供三維結構支持,并減少膠質瘢痕的形成[9]。殼聚糖性質穩定,具有較好的生物相容性和降解性,且對神經電活動幾乎無影響,顱內應用具有安全性,被廣泛應用于醫藥學、組織工程等領域[10]。MC3T3-E1 細胞在殼聚糖支架上培養時表現出快速增殖的潛能[11]。有研究發現殼聚糖-藻酸鹽支架與 BMSCs 復合構建的組織工程脊髓,對大鼠急性脊髓損傷修復有促進作用[12]。本研究擬將 BMSCs 與殼聚糖多孔支架共培養構建組織工程復合體,然后移植于大鼠 TBI 模型,觀察其能否改善大鼠神經功能。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
健康成年雄性 SD 大鼠 51 只,體質量(250±50)g,由鄭州大學動物中心提供,置于清潔、恒溫環境中飼養。
殼聚糖(上海生工生物工程股份有限公司);DMEM/F-12(1∶1)培養基、FBS[賽默飛世爾生物化學制品(北京)有限公司];0.25% 胰蛋白酶-0.02%EDTA(BioInd 公司,美國);FITC 標記的抗小鼠/大鼠 CD29 抗體、PE 標記的抗大鼠 CD45RA 抗體(BioLegend 公司,美國);抗 BrdU 抗體-增殖標記綿羊多克隆抗體(Abcam 公司,美國);抗高分子量神經絲蛋白(neurofilament triplet H,NF-H)(RMdO 20)小鼠單克隆抗體、抗神經膠質酸性蛋白(glial fibrillary acidic protein,GFAP)(GA5)小鼠單克隆抗體(CST 公司,美國);辣根過氧化物酶標記的親和兔抗綿羊 IgG(H+L)抗體(EarthOx 公司,美國);辣根過氧化物酶標記的山羊抗小鼠 IgG 抗體(北京中杉金橋生物技術有限公司);BrdU(Sigma 公司,美國);環孢素注射液(NOVARTIS 公司,瑞士)。
流式細胞儀(Becton Dicknson 公司,美國);掃描電鏡(Hitachi 公司,日本);酶聯免疫檢測儀(Biotek 公司,美國);腦立體定位儀(Stoelting 公司,美國)。
1.2 BMSCs 分離培養、鑒定及標記
取 1 只 SD 大鼠頸椎脫臼法處死,消毒后于超凈工作臺內取其雙側股骨及脛骨骨髓,分裝于數個含有完全培養基(含 10%FBS、100 U/mL 青霉素、100 μg/mL 鏈霉素的 DMEM/F-12 培養基)的 25 cm2塑料培養瓶中,37℃、5%CO2及飽和濕度培養箱中培養,每 3 天全量更換完全培養基 1 次,待細胞鋪滿培養瓶底 80%~90% 時,用 0.25% 胰蛋白酶-0.02%EDTA 按 1∶2 比例傳代;傳至第 3 代時用 FITC 標記的抗小鼠/大鼠 CD29 抗體和 PE 標記的抗大鼠 CD45RA 抗體在流式細胞儀上進行鑒定。
取第 3 代 BMSCs,于培養瓶中加入 100 μL 無菌抽濾的 0.5 mmol/L BrdU-PBS 液,使培養基中 BrdU 終濃度約為 10 μmol/L,置于 37℃、5%CO2及飽和濕度培養箱中培養,備用。
1.3 殼聚糖多孔支架的制備及觀測
1.3.1 殼聚糖多孔支架制備
將 2 g 殼聚糖溶于 100 mL 1% 乙酸溶液中,采用冷凍干燥法[13]制備殼聚糖多孔支架。
1.3.2 殼聚糖多孔支架孔隙率檢測
將經滅菌處理的殼聚糖多孔支架移入超凈臺中,用經高壓蒸氣滅菌的 0.01 mol/L PBS 緩沖液(pH7.2)清洗 3 次,每次 10 min;再用完全培養基清洗 2 次,每次 10 min,吸去清洗液后重新加入完全培養基浸泡 24 h。用乙醇替代法[14]檢測其孔隙率,并在掃描電鏡下觀察其內部結構。
1.3.3 MTT 法檢測 BMSCs 在殼聚糖多孔支架內生長情況
取經 BrdU 標記的第 3 代 BMSCs,以密度 1×104 個/孔分別接種于放置于 96 孔培養板中的殼聚糖多孔支架上(實驗組)和不含殼聚糖支架的 96 孔培養板孔內(對照組),均加入 200 μL 完全培養基,37℃、5%CO2及飽和濕度培養箱中培養。分別于培養 1、2、4、7、10、13 d 每組隨機取 3 孔,每孔加入 20 μL 5 mg/mL MTT,置于培養箱培養 4 h;棄培養液,加入 DMSO 150 μL,震蕩 15 min,用酶聯免疫檢測儀于波長 570 nm 處檢測吸光度(A)值。
1.3.4 支架-細胞體外共培養掃描電鏡觀察
取經 BrdU 標記的第 3 代 BMSCs,以 1×106 個/mL 密度接種于置于 24 孔培養板孔內經滅菌處理的殼聚糖多孔支架上,置于 37℃、5%CO2及飽和濕度培養箱共培養 48 h 后,掃描電鏡下觀察。
1.4 大鼠 TBI 修復實驗
1.4.1 實驗分組及方法
取 50 只 SD 大鼠,采用隨機數字表法分為 5 組,每組 10 只。A 組為 BMSCs -殼聚糖多孔支架移植組,B 組為 BMSCs 移植組,C 組為殼聚糖多孔支架移植組,D 組為損傷對照組,E 組為假手術組。
TBI 造模方法:將 A~D 組大鼠用 10% 水合氯醛腹腔注射麻醉后固定于腦立體定位儀上,頭皮剪毛后常規消毒;沿大鼠頭頂矢狀位中線切開頭皮(切口約長 1 cm),向兩側分離以暴露前囟、矢狀縫和冠狀縫,以冠狀縫后 1.5 mm、矢狀縫左旁 2.5 mm 為中心,用牙科磨鉆鉆一直徑 5 mm 的圓形骨窗,保持硬腦膜完整;在骨窗上方垂直固定改良的 Feeney 自由落體打擊裝置,以 500 g·cm 的致傷力造成大鼠左側皮質局限性創傷;打擊后立即移開打擊裝置,如大鼠出現短暫的四肢抽搐、呼吸暫停數秒,提示 TBI 模型制備成功。然后清創止血、縫合頭皮,待動物清醒后分籠飼養。術后青霉素 10 萬 U 肌肉注射。E 組大鼠同上法麻醉后,僅切開頭皮和顱骨開窗,不制備 TBI模型,作為假手術組。
大鼠造模后 72 h 使用 10% 水合氯醛腹腔注射麻醉,俯臥位固定于腦立體定位儀上,消毒手術切口后拆線。各組大鼠清創后,A、B、C 組分別取共培養 48 h 的 BrdU 標記 BMSCs-殼聚糖多孔支架復合體、體外培養 48 h 的 BrdU 標記 BMSCs、體外培養 48 h 的殼聚糖多孔支架移植于腦創傷區,D 組于腦創傷區注射等量完全培養基,E 組大鼠直接縫合頭皮。各組大鼠于細胞移植前 12 h 及移植后 1~5 d 每天尾靜脈注射環孢素 1 次,縫合頭皮后均肌肉注射青霉素 10 萬 U。
1.4.2 改良神經功能缺損評分(modified neurological severity scores,mNSS)
分別于造模前及造模后 1、7、14、35 d,對各組大鼠行 mNSS 評分[5],評估大鼠 TBI 后的神經功能修復情況。
1.4.3 Morris 水迷宮測驗
造模后對各組大鼠進行 Morris 水迷宮測驗,包括定位航行測驗(造模后 31~35 d 連續 5 d 檢測潛伏期)及空間探索測驗(造模后 35 d 檢測穿越平臺次數)。
1.4.4 HE 染色
造模后 36 d 所有大鼠行斷頭取腦,石蠟包埋、切片,取部分切片行 HE 染色觀察。
1.4.5 免疫組織化學雙重染色
造模后 36 d 取上述部分石蠟切片進行免疫組織化學染色,酶聯免疫檢測儀下觀察。① BrdU 和 GFAP 雙重染色方法:取相鄰腦組織切片中的 1 片,常規脫蠟至水,抗原修復,加兔血清封閉 1 h,滴加約 50 μL 綿羊抗 BrdU 一抗工作液(1∶130),4℃ 過夜;再滴加約 50 μL 辣根過氧化物酶標記的兔抗綿羊二抗工作液(1∶500),顯色后蘇木素復染,封片。再取相鄰腦組織切片中的另 1 片,常規脫蠟至水,抗原修復,加山羊血清封閉 1 h,滴加約 50 μL 小鼠抗 GFAP 一抗工作液(1∶50),4℃ 過夜;再滴加約 50 μL 辣根過氧化物酶標記的山羊抗小鼠二抗工作液(1∶500),顯色后蘇木素復染,封片。② BrdU 和 NF-H 雙重染色方法:取相鄰腦組織切片中的 1 片,常規脫蠟至水,抗原修復,加兔血清封閉 1 h,滴加約 50 μL 綿羊抗 BrdU 一抗工作液(1∶130),4℃ 過夜,再滴加約 50 μL 辣根過氧化物酶標記的兔抗綿羊二抗工作液(1∶500),顯色后蘇木素復染,封片。再取相鄰腦組織切片中的另 1 片,常規脫蠟至水,抗原修復,加山羊血清封閉 1 h,滴加約 50 μL 小鼠抗 NF-H 一抗工作液(1∶200),4℃ 過夜,滴加約 50 μL 辣根過氧化物酶標記的山羊抗小鼠二抗工作液(1∶500),顯色后蘇木素復染,封片。
1.5 統計學方法
采用 SPSS13.0 統計軟件進行分析。數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用 LSD 檢驗;組內各時間點間比較采用重復測量方差分析,兩兩比較采用配對t檢驗;檢驗水準 α=0.05。
2 結果
2.1 BMSCs 鑒定
流式細胞儀檢測示,采用全骨髓貼壁法培養傳至第 3 代的 BMSCs,CD29 陽性率為 98.49%,CD45 陽性率僅為 0.85%。見圖 1。
2.2 殼聚糖多孔支架相關觀測
乙醇替代法檢測殼聚糖多孔支架的孔隙率為 90.0%±0.5%。掃描電鏡可見支架橫斷面內部密布大小相對均一的孔洞,孔相通性較好,孔徑為 80~200 μm,平均 140 μm。支架-細胞復合培養 48 h 掃描電鏡觀察示,BMSCs 廣泛分布于殼聚糖多孔支架表面及孔內,細胞呈梭形并分泌細胞外基質黏附于支架上,其在三維培養環境下生長良好。見圖 2。
MTT 法檢測示,兩組細胞生長曲線趨勢相似,復合培養 1、2 d 為生長潛伏期,4、7 d 進入快速增長期,10~13 d 為平臺期。培養 7、10、13 d 時實驗組 A 值顯著高于對照組,差異有統計學意義(P<0.05)。見圖 3。
2.3 大鼠 TBI 修復實驗
2.3.1 mNSS 評分
造模后 1 d 各組 mNSS 評分均達峰值,隨時間延長呈下降趨勢。造模后 1 d A~D 組 mNSS 評分均顯著高于 E 組,差異有統計學意義(P<0.05);A~D 組間差異無統計學意義(P>0.05)。造模后 35 d A、E 組 mNSS 評分顯著低于 B、C、D 組,B 組低于 C、D 組,比較差異均有統計學意義(P<0.05);A、E 組間及 C、D 組間比較差異無統計學意義(P>0.05))。見圖 4。
2.3.2 Morris 水迷宮測試
定位航行測驗結果顯示,造模后 31~35 d,各組潛伏期均逐漸下降。各時間點 A、E 組潛伏期均顯著低于 B、C、D 組,B 組低于 C、D 組,比較差異均有統計學意義(P<0.05);A、E 組間及 C、D 組間比較差異無統計學意義(P>0.05)。見圖 5。
空間探索測驗結果示,造模后 35 d A~E 組穿越平臺次數分別為(9.580±1.281)、(6.080±0.736)、(3.250±0.689)、(1.667±0.753)、(9.750±1.129)次,A、E 組顯著高于 B、C、D 組,B 組高于 C、D 組,C 組高于 D 組,差異均有統計學意義(P<0.05);A、E 組間比較差異無統計學意義(P>0.05)。
2.3.3 HE 染色觀察
造模后 36 d HE 染色示:A 組可見皮層損傷區內殼聚糖多孔支架(磚紅色)結構,內有細胞填充,亦可見在損傷灶底層有正常腦組織長入,殼聚糖多孔支架已部分降解;B 組在損傷區可見細胞團,與正常腦組織融合不緊密;C 組腦損傷區可見殼聚糖多孔支架,其內有少量細胞長入;D 組左側腦皮層可見明顯的損傷灶缺損;E 組大鼠未見腦損傷區。見圖 6。
2.3.4 免疫組織化學雙重染色觀察
BrdU 與 NF-H 雙重染色法以及 BrdU 與 GFAP 雙重染色法結果示,造模后 36 d A 組大鼠 BrdU 標記的 BMSCs 仍然存活并且能分化為神經元和神經膠質細胞,部分分化的神經細胞已遷移至損傷區周圍,甚至進入正常腦組織內,而部分正常腦組織細胞也長入移植復合體內;B 組大鼠腦損傷區可見與正常腦組織融合不緊密的細胞團,而其損傷區周圍正常的腦組織內亦可見散在分布的 BMSCs 來源的神經元和神經膠質細胞;C 組大鼠腦損傷區可見殼聚糖多孔支架,支架內有細胞附著,但未發現 BMSCs 來源的神經元和神經膠質細胞;D 組大鼠腦損傷區無明顯改變;E 組大鼠無腦損傷區。見圖 7、8。
 圖1
第 3 代 BMSCs 流式細胞儀檢測
圖1
第 3 代 BMSCs 流式細胞儀檢測
a. CD29;b. CD45
Figure1. Flow cytometry detection of the 3rd generation BMSCsa. CD29; b. CD45
 圖2
掃描電鏡觀察(×200)
圖2
掃描電鏡觀察(×200)
a. 殼聚糖多孔支架;b. 支架-細胞復合培養 2 d
Figure2. Scanning electron microscope observation (×200)a. Chitosan porous scaffold; b. Scaffold-cell co-cultured for 2 days
 圖3
MTT 法檢測 BMSCs 在支架材料中的生長曲線
Figure3.
Growth curve of BMSCs in scaffolds by MTT assay
圖3
MTT 法檢測 BMSCs 在支架材料中的生長曲線
Figure3.
Growth curve of BMSCs in scaffolds by MTT assay
 圖4
各時間點各組大鼠 mNSS 評分比較
Figure4.
Comparison of mNSS scores of rats in each group at different time points
圖4
各時間點各組大鼠 mNSS 評分比較
Figure4.
Comparison of mNSS scores of rats in each group at different time points
 圖5
各時間點各組大鼠定位航行測驗潛伏期
Figure5.
Positioning voyage test’s incubation period of rats in each group at different time points
圖5
各時間點各組大鼠定位航行測驗潛伏期
Figure5.
Positioning voyage test’s incubation period of rats in each group at different time points
 圖6
造模后 36 d 各組大鼠 HE 染色觀察
圖6
造模后 36 d 各組大鼠 HE 染色觀察
a. A 組(×10);b. B 組(×4);c. C 組(×10);d. D 組(×4);e. E 組(×40)
Figure6. HE staining observation of rats in each group at 36 days after TBIa. Group A (×10); b. Group B (×4); c. Group C (×10); d. Group D (×4); e. Group E (×40)
 圖7
造模后 36 d 各組大鼠 BrdU 與 NF-H 雙重染色觀察
圖7
造模后 36 d 各組大鼠 BrdU 與 NF-H 雙重染色觀察
a. A 組 BrdU 染色(×10);b. A 組 NF-H 染色(×20);c. B 組 BrdU 染色(×10);d. B 組 NF-H 染色(×40);e. C 組 BrdU 染色(×40);f. C 組 NF-H 染色(×20);g. D 組 BrdU 染色(×10);h. D 組 NF-H 染色(×40);i. E 組 BrdU 染色(×40);j. E 組 NF-H 染色(×40)
Figure7. BrdU and NF-H immunohistochemistry double staining observation of rats in each group at 36 days after TBIa. BrdU staining of group A (×10); b. NF-H staining of group A (×20); c. BrdU staining of group B (×10); d. NF-H staining of group B (×40); e. BrdU staining of group C (×40); f. NF-H staining of group C (×20); g. BrdU staining of group D (×10); h. NF-H staining of group D (×40); i. BrdU staining of group E (×40); j. NF-H staining of group E (×40)
 圖8
造模后 36 d 各組大鼠 BrdU 與 GFAP 雙重染色觀察
圖8
造模后 36 d 各組大鼠 BrdU 與 GFAP 雙重染色觀察
a. A 組 BrdU 染色(×10);b. A 組 GFAP 染色(×40);c. B 組 BrdU 染色(×10);d. B 組 GFAP 染色(×10);e. C 組 BrdU 染色(×40);f. C 組 GFAP 染色(×20);g. D 組 BrdU 染色(×10);h. D 組 GFAP 染色(×10);i. E 組 BrdU 染色(×40);j. E 組 GFAP 染色(×40)
Figure8. BrdU and GFAP immunohistochemistry double staining observation of rats in each group at 36 days after TBIa. BrdU staining of group A (×10); b. GFAP staining of group A (×40); c. BrdU staining of group B (×10); d. GFAP staining of group B (×10); e. BrdU staining of group C (×40); f. GFAP staining of group C (×20); g. BrdU staining of group D (×10); h. GFAP staining of group D (×10); i. BrdU staining of group E (×40); j. GFAP staining of group E (×40)
3 討論
組織工程學的原理是將體外分離、培養并擴增的細胞,黏附于一種生物相容性好、能在體內降解的生物材料所制支架上,從而形成細胞-支架復合體,再將其植入機體組織或器官損傷區,支架在機體內逐漸降解吸收的過程中,其內黏附的細胞能形成新的組織或器官并具有相應的形態和功能,進而達到修復機體創傷和恢復機體功能的目的。生物材料支架所形成的三維結構能夠為細胞提供獲取營養和生長代謝的場所,生物材料支架的形狀直接影響黏附細胞的生長、增殖、遷移等活動。本實驗利用冷凍干燥法制備的殼聚糖多孔支架孔隙率為 90.0%±0.5%、孔徑為 80~200 μm,孔隙相對均勻、連通性好;且冷凍干燥法能避免高溫對支架表面生物活性分子的破壞。
TBI 的致死率和致殘率均較高[15]。腦損傷機制為腦創傷局部首先發生彌漫性的細胞壞死,接著發生細胞凋亡(繼發性損傷),最后星形膠質細胞激活形成膠質瘢痕[16]。通過靜脈輸注自體骨髓單核細胞可用于治療成人 TBI[17];但腦組織的自我修復能力有限,臨床上腦損傷的后期治療主要采用營養神經藥物配合功能訓練,療效不確切,很難達到修復受損神經元、重新建立突觸聯系,進而恢復神經功能的目的。
干細胞在局部微環境刺激下能增殖、分化為損傷區缺失的細胞,可起到細胞替代治療作用。作為組織工程的種子細胞,BMSCs 在細胞替代治療、基因治療以及組織器官的再造中具有重要的研究意義及臨床應用價值,被廣泛應用于組織工程研究中[18]。本實驗通過掃描電鏡和 MTT 檢測發現,BMSCs 在三維培養環境下生長良好,BMSCs 與殼聚糖多孔支架具有良好的生物相容性。
TBI 后 24 h 內,腦損傷區會產生大量細胞因子或毒素,如氧自由基、炎性細胞因子等,不利于移植細胞的存活[19];而在 TBI 后 72 h 左右,損傷區邊緣清晰、可形成壞死灶利于清創,更利于移植細胞的存活。因此,本研究于造模后 72 h 進行移植。移植細胞的長期存活并增殖分化為受損細胞是移植治療的關鍵,腦損傷后往往會有膠質瘢痕形成,進而阻止再生軸突進入損傷區與正常神經細胞形成突觸聯系,因此在損傷區重建組織結構以利于神經細胞再生很有必要。本實驗根據組織工程學原理進行殼聚糖多孔支架介導的 BMSCs 移植治療大鼠 TBI,HE 染色結果顯示移植后 A 組大鼠腦內移植復合體與損傷區周圍腦組織整合,移植物內存有較多細胞,與移植前相比,殼聚糖多孔支架已發生了部分降解。BrdU 與 NF-H 雙重染色以及 BrdU 與 GFAP 雙重染色結果表明,移植后 BrdU 標記的 BMSCs 存活并且能分化為神經元和神經膠質細胞,部分分化的神經細胞已遷移至損傷區周圍甚至進入正常腦組織內,而部分正常腦組織細胞也長入移植復合體內,再次表明 A 組大鼠腦內移植復合體與損傷區周圍腦組織整合。
大鼠 TBI 后會發生認知功能障礙和神經功能缺損[20],本實驗 mNSS 評分和 Morris 水迷宮測驗結果進一步驗證了該觀點。在 TBI 后 35 d,A 組 mNSS 評分顯著低于 B、C、D 組(P<0.05),與 E 組比較 mNSS 評分差異無統計學意義(P>0.05);定位航行測驗示,造模后 31~35 d A、E 組潛伏期均顯著低于 B、C、D 組,B 組低于 C、D 組(P<0.05),而 A、E 組間及 C、D 組間比較差異無統計學意義(P>0.05);空間探索測驗示,造模后 35 d A、E 組穿越平臺次數顯著高于 B、C、D 組,B 組高于 C、D 組,C 組高于 D 組,組間差異均有統計學意義(P<0.05);A、E 組間比較差異無統計學意義(P>0.05)。大鼠 TBI 后采用 BMSCs 復合殼聚糖多孔支架移植治療能顯著提高大鼠的認知功能(空間學習與記憶能力),其治療效果明顯優于單純的 BMSCs 或殼聚糖多孔支架移植治療。
結合以往研究和本實驗結果,我們認為殼聚糖多孔支架介導的 BMSCs 移植治療大鼠 TBI 后,大鼠認知功能與神經功能缺損改善的機制可能包括:① 在腦表面局部應用的 BMSCs 能夠遷移至腦外傷區域[21],分化為神經元和神經膠質細胞,部分重建了損傷局部的神經回路,從而代償損傷細胞的部分功能;② BMSCs 能分泌腦源性神經營養因子、VEGF 等,促進血管新生,也能改善大腦局部微環境,減輕 TBI 后的繼發性神經功能損害,促進神經功能的恢復[22-23];③ 移植的 BMSCs 能夠刺激肺巨噬細胞并且增強脾臟對調節性 T 細胞的產生,導致循環系統抗炎細胞因子的增加和中樞神經系統局部環境的改變,從而起到神經保護作用[24];④ 移植復合體中的殼聚糖多孔支架能抑制膠質瘢痕形成,有利于移植復合體與正常腦組織間建立新的突觸聯系。
綜上述,殼聚糖多孔支架能為 BMSCs 提供三維結構的生長環境,BMSCs 能在腦局部微環境刺激下分化為神經細胞,并與正常腦組織建立聯系,從而促進 TBI 大鼠神經功能的修復。但如何控制 BMSCs 分化成神經元和神經膠質細胞的比例,使 BMSCs 分化成更多的神經元,仍需要進一步研究。