本研究采用 5~20 wt% 的三甲氧基硅基丙基十八烷基二甲氧氯化銨(QAS)改性聚己內酯(PCL)/明膠復合材料(PG-Q),再通過靜電紡絲技術制備出一種非溶出廣譜抑菌型納米纖維膜。掃描電鏡和透射電鏡觀察表明 QAS 能促使明膠和 PCL 的相分離。動態水接觸角結果證明 QAS 能夠提高膜的表面憎水性,有利于敷料與傷口剝離。傅里葉變換紅外光譜結果證明 QAS 與 PCL 及明膠之間存在著氫鍵及化學交聯作用,有利于長效抑菌。此外,PG-Q 膜具有良好的細胞親和性。其中 QAS 占 15 wt% 及 20 wt% 的樣品 12 h 后對金葡菌及綠膿桿菌的抑制率均超過 99%。該 PG-Q 膜可作為一種抑菌型傷口敷料用于創面護理。
引用本文: 石銳, 耿歡, 張靜爽, 田偉. 一種非溶出廣譜抑菌型聚己內酯/明膠-有機硅季銨鹽納米纖維膜用于傷口敷料. 生物醫學工程學雜志, 2018, 35(3): 396-402. doi: 10.7507/1001-5515.201701020 復制
引言
皮膚對于病原體具有天然的屏障作用,大量文獻報道傷口破損容易引發病原體在創面的聚集從而造成傷口感染[1]。一旦發生難愈合的傷口感染,將會給患者造成極大的痛苦以及醫療負擔[2]。因此,制備抗感染的傷口敷料對于保護傷口以及抑制傷口感染具有極其重要的意義。
傷口敷料具有吸收滲出液、防止水分流失以及防止細菌侵入傷口的作用。利用抗菌型敷料對感染傷口進行處理可以提高細胞內皮化速率及促進傷口愈合[3]。溶出型抗菌敷料的抑菌原理是在基體材料中加載一種或多種抑菌劑,如抗生素[4-6]、銀納米粒子[7-9]及季銨鹽(trimethoxysilylpropyl octadecyldimethyl ammonium chloride,QAS)[10]等,抑菌物質逐漸溶出釋放到敷料周圍從而殺滅細菌。然而,基于藥物釋放的溶出型傷口敷料存在一些缺陷,如:① 隨著藥物的釋放,敷料的機械性能下降且完整性被破壞;② 藥物釋放時間短且難以控制;③ 難以做到可控釋放,短暫大量突釋會對周圍組織產生毒性。而非溶出型敷料卻可以克服以上不足,從而達到長效持久抑菌的效果。
QAS 具有廣譜抑菌效果及高效抑菌活力,能夠有效殺滅革蘭陽性菌、革蘭陰性菌及真菌。QAS 是一種具有雙官能團的新型有機硅季銨鹽,該季銨鹽分子結構中含有一個硅氧鍵,能夠在溫和的條件下與羥基發生反應;此外,其長鏈烷基上含有帶正電荷的季銨基團能夠提供抑菌活性[11]。據文獻報道,QAS 可能的抗菌機制有兩種:QAS 表面的陽離子基團與細菌膜表面的負電荷發生反應,導致細菌膜表面電荷分散不均從而造成膜破裂和細菌死亡;長鏈烷基穿透細菌膜進入細菌內部從而改變細菌膜的理化性能,引發細菌內容物泄漏從而殺滅細菌[12]。
目前,QAS 已經作為消毒材料被廣泛應用于紡織工業、醫療消毒以及包裝材料。QAS 還被用于二氧化硅納米粒子的表面改性且表現出優異的抗菌性能[13]。Andresen 等[14]利用 QAS 通過簡單的吸收-固化法改性了纖維素膜表面,并指出該改性的纖維素膜對于傷口修復具有良好的效果。許多天然及人工合成高分子材料表面含有大量羥基和羧基,隨著溫度升高,大多能與 QAS 上的硅氧鍵發生反應并將 QAS 以化學鍵結合在膜表面,從而在基體表面形成一種抑菌的網絡結構。并且,Si-O-Si 基團的穩定性很強,因而能夠實現長效抑菌的功效。
靜電紡絲是最直接有效制備微納尺度纖維膜的方法。由于靜電紡絲膜具有高比表面積、貫穿孔以及高孔隙率,因此非常適合作為傷口敷料用來止血、透氣、保持水分及排出滲出液。與其他常見可降解高分子材料比較,如膠原、聚乳酸及聚乙醇酸等,聚己內酯[poly(ε-caprolactone),PCL]具有無免疫原性、降解過程不產生酸堆積、生物相容性好、柔韌性強、力學強度高、共混相容性好等諸多優點,使其在生物醫用領域有著廣泛的應用[15]。因此,本研究擬采用 PCL 作為基體材料制備纖維膜。但是由于 PCL 在體內的吸收時間為 2~3 年[16],這對于可吸收隔離膜來說過于緩慢。此外,PCL 屬于疏水性聚合物,不利于細胞黏附。因此,為了改善 PCL 的降解性能及生物相容性,需要將 PCL 與其他降解速率快且親水性能好的聚合物共混或共聚。明膠是膠原的水解產物,不但降解吸收速率快、無免疫原性,而且明膠分子上保留了大量有助于細胞黏附、分化及增殖的氨基酸序列[17],因此,本研究選用明膠與 PCL 共混制備復合納米纖維膜從而提高膜的相容性及降解速率。
本研究通過 QAS 改性 PG 復合材料,再通過靜電紡絲技術將該復合材料(PG-Q)制備成納米纖維膜,從而獲得一種非溶出廣譜抑菌且接觸式殺菌型傷口敷料。本文研究了 QAS 的加入對于膜形態、表面親水、抑菌活性以及細胞相容性的影響,將為制備新型的非溶出型抑菌敷料奠定基礎。
1 試劑和方法
1.1 原料、試劑和主要儀器
QAS 購自英國 Fluorochem 公司;PCL(Mn = 70~90 kD)、明膠及 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽購自德國 Sigma-Aldrich 公司;四氟乙烯(tetrafluoroethylene,TFE)(純度 99.8%)購自美國 Aladdin 公司;標準型光學接觸角測定儀(SL200A)購自中國上海賽龍科技有限公司;掃描電子顯微鏡(scanning electron microscopy,SEM,Hitachi S-4700)、透射電子顯微鏡(transmission electron microscopy,TEM,JEM-2100F)購自日本日立公司。
1.2 靜電紡絲膜的制備
PCL-明膠(PG)溶液的配置是將 6 wt% 的 PCL/TFE 與 6 wt% 的明膠/TFE 以 70∶30 的質量比混合。將 PCL 與明膠總質量 5~20% 的 QAS 添加至 PG 溶液中。所有的溶液在 60℃ 下磁力攪拌 12 h。紡絲液擠出速率為 1.3 mL/h,電壓 8~20 kV,接收鋁箔滾筒轉速為 300 r/min。接收滾筒距離為 20 cm,樣品 PG、PG-Q5、PG-Q10、PG-Q15、PG-Q20 分別表示 QAS 含量占聚合物質量的 0%、5%、10%、15% 及 20%。
1.3 表面形貌及纖維形貌
用 SEM 對樣品 PG、PG-Q5、PG-Q10、PG-Q15、PG-Q20 的表面形貌進行形態觀察。再用去離子水將膜反復清洗后,得到樣品 PG’、PG-Q5’、PG-Q10’、PG-Q15’、PG-Q20’,再次用 SEM 觀察膜的表面形貌。膜表面經過噴金處理。掃描電壓 20 kV。
TEM 用來觀察紡絲纖維的結構,觀察樣品為 PG-Q10。測試電壓 200 kV,暗電流 95 μA,發射束流 126 μA。
1.4 化學結構
傅里葉紅外測試(Fourier transform infrared,FTIR)用來研究用于電紡絲的復合材料中各組分間(PCL、明膠及 QAS)的相互作用。采用 Bruker Tensor 27 分光儀,掃描范圍是 400~4 000 cm–1,分辨率為 2 cm–1。測試樣品分為:(a)不同季銨鹽組分的納米纖維膜(PG、PG-Q5、PG-Q10、PG-Q15、PG-Q20);(b)單一組分(PCL、明膠、QAS);(c)PCL 與 PCL-QAS 復合材料;(d)明膠與明膠-QAS。
1.5 靜態接觸角
使用 SL200A-標準型光學接觸角測定儀測量膜的靜態接觸角(water contact angle,WCA)。測試樣品為含有不同季銨鹽組分的納米纖維膜 PG、PG-Q5、PG-Q10、PG-Q15、PG-Q20。拍照時間點分別為 0、1、2、5 及 10 s。
1.6 細胞毒性試驗
為了檢測有機硅季銨鹽以及材料中的有機溶劑對細胞毒性的影響,我們采用四甲基偶氮唑藍(methyl thiazolyl tetrazolium,MTT)法來測試細胞毒性。
材料浸提液的制備:將大小 20 mm × 30 mm 的樣品,用 75%(v/v)酒精清洗后按照 3 cm2/mL 浸泡在 37℃ 的 DMEM 中 24 h,再通過孔徑 0.22 μm 的過濾器過濾獲得測試樣品的浸提液。
測試材料的分組情況分別為:組織培養板(tissue culture plate,TCP)以及含不同質量百分比的季銨鹽的樣品 PG、PG-Q5、PG-Q10、PG-Q15、PG-Q20。
MTT 法檢測細胞毒性:用 96 孔板培養小鼠成纖維細胞 L929,接種細胞濃度為 5 × 104/mL,24 h 后吸去培養液,加入等量材料浸提液,陰性對照用含有 10% 胎牛血清(fetal bovine serum,FBS)的 DMEM 培養液,分別于 24、48 及 72 h,經 5 mg/mL MTT 和酸化異丙醇處理后,用酶聯儀在 630 nm 波長測其吸光度值,取平均值。計算細胞相對增殖率(relative growth rate,RGR):RGR =(試樣 OD 值 – 空白 OD 值)/(陰性 OD 值 – 空白 OD 值)。
1.7 抑菌性能
依據 GB15979-2002 國家標準《一次性使用衛生用品衛生標準》和接觸性創面敷料試驗方法,采用非溶出性抗菌產品抑菌性能動態搖瓶法來測定納米纖維膜的抑菌性。菌種選用臨床上易引起傷口感染的兩種常見菌:金黃色葡萄球菌和綠膿桿菌。設置不同 QAS 含量的 PG-Q(PG-Q5、PG-Q10、PG-Q15、PG-Q20)納米纖維膜與菌種共培養作為實驗組,PG 膜與菌種共培養作為材料對照組,空白組為單獨菌種培育。
將細菌培養于溶原性肉湯(lysogeny broth,LB)溶液中,置于 37℃ 恒溫搖床中培養 24 h。此后再將兩種菌液各 1 mL 轉移至含 50 mL 新鮮 LB 溶液的燒瓶中。37℃ 恒溫搖床中再培養 5 h,從而獲得細菌懸液。此后,將兩種細菌的懸液用無菌生理鹽水稀釋到 1 × 106 CFU/mL(CFU:菌落形成單位,colony-forming units)。將直徑為 2 cm2的膜浸在 10 mL 細菌懸液(含 1 mL 細菌懸液和 9 mL 生理鹽水)并置于密閉容器中,再將容器置于 37℃、170 r/min 的恒溫搖床中分別培養 3、6 及 12 h。在預設時間點將 100 μL 的 10 倍稀釋菌液加入瓊脂板上。瓊脂板在 37℃ 下孵育 12 h,觀察細菌的增殖。最后,對 CFU 計數,計算細菌殺死率。
1.8 統計學處理
所有的實驗數據以均值 ± 標準誤表示,采用 SPSS 17.0 軟件對實驗結果進行統計學分析,兩組間比較采用 t 檢驗,多組間比較采用方差分析。P < 0.05 認為差異具有統計學意義。
2 結果與討論
2.1 表面形貌
靜電紡絲納米纖維膜的 SEM 圖像如圖 1 所示。與未加入 QAS 的 PG 膜相比,含 QAS 的 PG-Q 納米纖維膜結構完整,纖維表面光滑連續,無串珠形成。這是由于帶正電荷的 QAS 加入后,三甲氧基硅烷基團水解形成的硅羥基與 PCL 和明膠分子鏈上的羥基、羧基等發生脫水縮合,從而將帶正電的季銨鹽基團鍵合在紡絲基體上。
 圖1
水洗前及水洗后不同 QAS 含量的 PG-Q 靜電紡絲膜的掃描電鏡圖片
圖1
水洗前及水洗后不同 QAS 含量的 PG-Q 靜電紡絲膜的掃描電鏡圖片
黑色箭頭表示亞網絡結構
Figure1. The SEM images of the electrospun nanofibrous membranes containing different QAS components before and after washed with ultrapure waterthe black arrows showed the subnet structure
當電場中電壓足夠強時,帶電射流會在電壓作用下進一步延伸為單獨的纖維或分絲成幾根纖維。如圖 1 中箭頭所示,在 PG-Q5 和 PG-Q10 中存在少量的纖維直徑在 10 nm 以下的亞網絡結構纖維。我們推斷這種亞網絡結構是由于紡絲過程中明膠的相分離形成的。而當季銨鹽含量高于 15% 時,亞網絡結構消失,但出現直徑為數十納米的超細纖維。
為了證實這種亞網絡結構的主要成分是分相后的明膠,我們對去離子水反復清洗后的納米纖維膜進行了 SEM 表征,結果表明水洗后的納米纖維膜中亞網絡結構消失,但纖維膜的整體形貌未發生明顯改變,該結果側面證實亞網絡結構的主要成分為易溶于水的明膠,而疏水的 PCL 則有利于纖維形貌結構保持完整。
如表 1 所示,隨著 QAS 含量的增多,纖維直徑及其分布都有所增大,水洗后纖維輕微溶脹,直徑略有增加但直徑分布變窄。纖維直徑分布變窄是由于亞網絡結構消失,纖維直徑趨于均一化,這也從另一方面證實了亞網絡結構是由具有良好親水性的明膠分相后形成的。
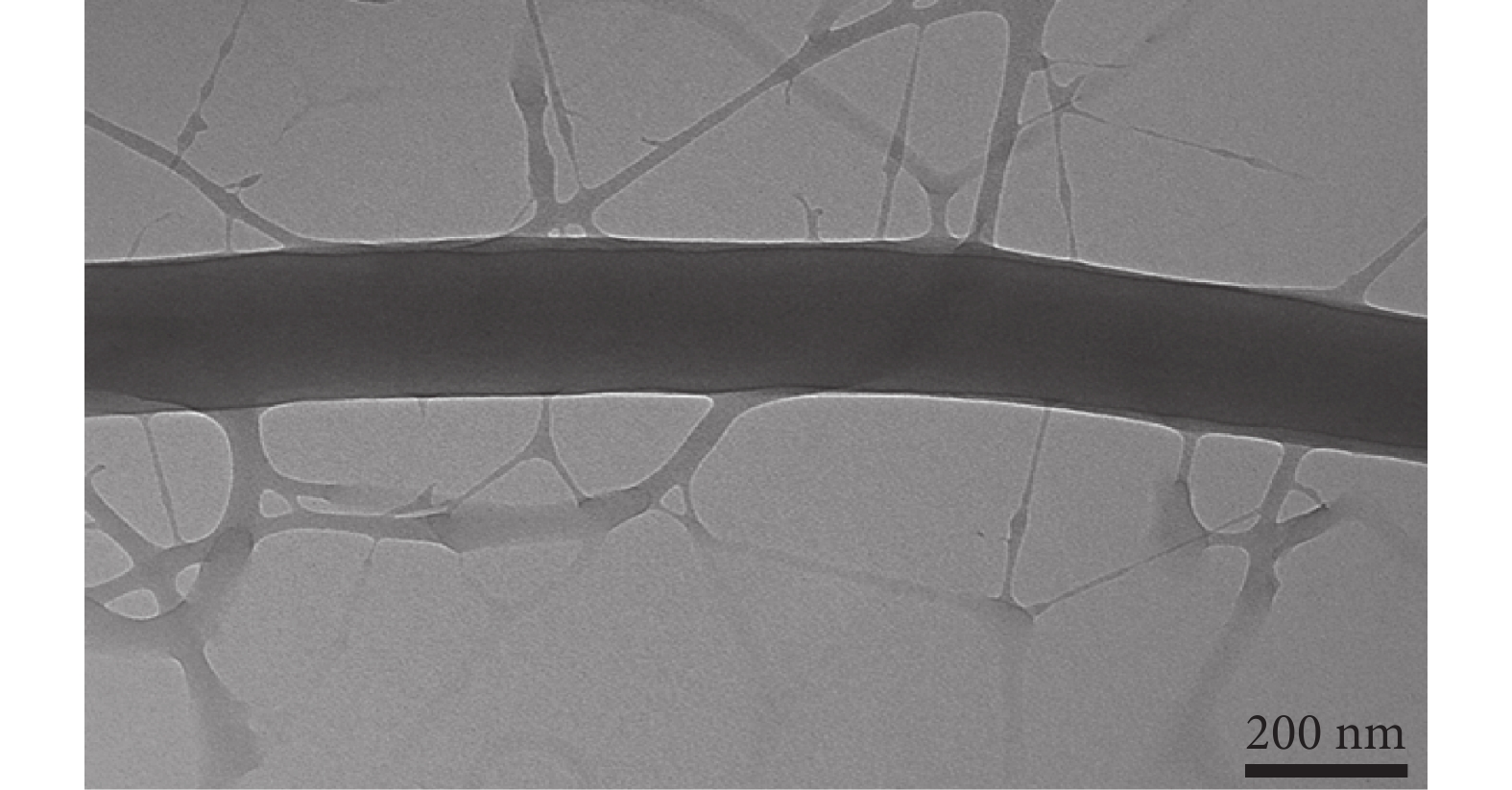
對 PG-Q10 進行 TEM 觀察(見圖 2),可以清晰地看到纖維內部出現相分離結構,由于密度和襯度不同,纖維內層顏色較深的為 PCL,纖維外部顏色較淺的為明膠,這與圖 1 中 PG-Q5 和 PG-Q10 中出現的亞網絡結構相對應,再一次證實了亞網絡結構是由明膠分相后形成的。
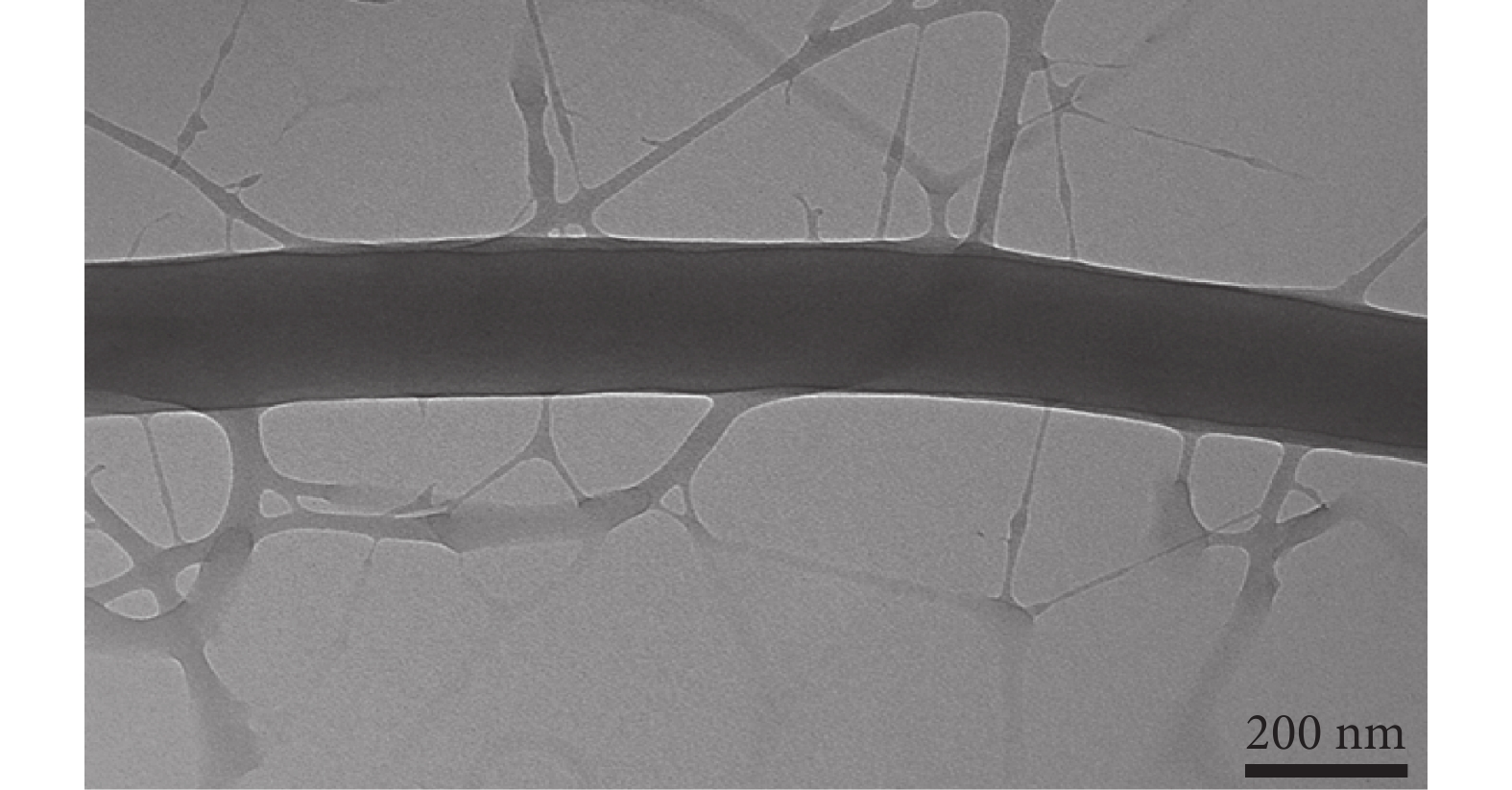 圖2
QAS 質量分數為 10% 的 PG-Q10 樣品的 TEM 圖片
Figure2.
The TEM image of the PG-Q10 containing 10 wt% QAS
圖2
QAS 質量分數為 10% 的 PG-Q10 樣品的 TEM 圖片
Figure2.
The TEM image of the PG-Q10 containing 10 wt% QAS
此外,從圖 1 中可見不同樣品納米纖維膜的孔徑為 0.5~4 μm,遠小于臨床現有敷料的孔徑,從而能夠更有效地阻止細菌的透過,同時還有利于氣體的交換。
2.2 不同組分間相互作用
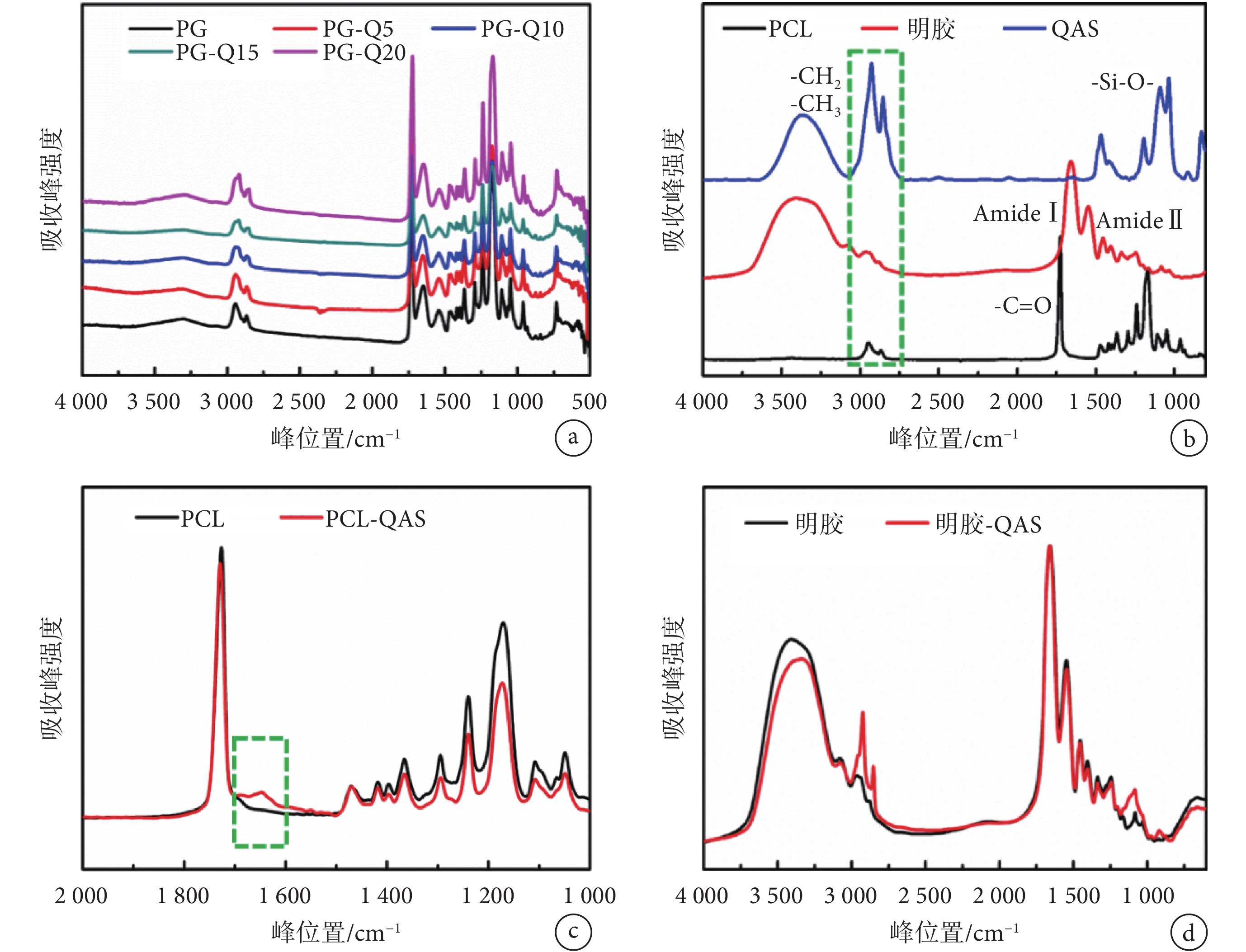
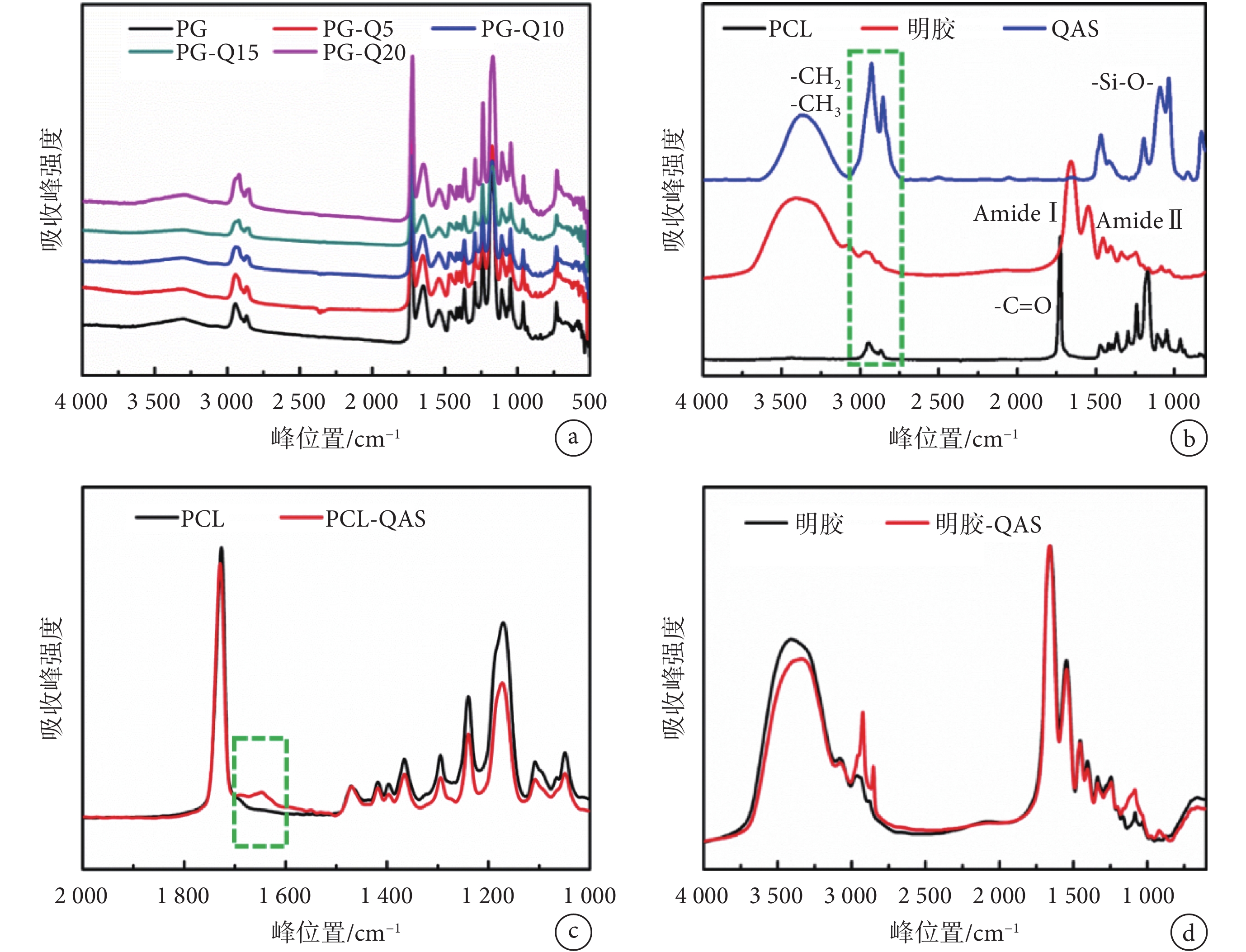 圖3
不同樣品紅外譜圖的對比
圖3
不同樣品紅外譜圖的對比
a.含有不同季銨鹽組分的納米纖維膜;b.單一組分;c. PCL 與 PCL-QAS 復合材料;d.明膠與明膠-QAS 復合材料
Figure3. Infrared spectrums of different samplesa. nanometer fiber membranes containing different QAS components; b. single component; c. PCL and PCL-QAS composites; d. gelatin and gelatin-QAS composites
圖 3a 是含有不同 QAS 組分的有機硅季銨鹽聚己內酯明膠納米纖維膜的紅外譜圖。如圖 3b 所示,PCL 的紅外譜圖中,2 800~2 900 cm–1是 CH3 和 CH2 的伸縮振動峰,1 725 cm–1是羰基峰;1 650、1 550 cm–1是明膠中酰胺Ⅰ和酰胺Ⅱ鍵(1 650 cm–1是酰胺Ⅰ鍵,反對稱-COOH 或 C=O 振動;1 550 cm–1為酰胺Ⅱ鍵,C-N 伸縮或 N-H 彎曲振動);1 088 cm–1是 QAS 中的 Si-O 鍵。
如圖 3c 所示,PCL 譜圖中 1 725 cm–1中的 C=O 伸縮振動峰在加入 QAS 后向 1 647 cm–1低波數偏移,是由于硅羥基和羰基酯鍵形成氫鍵,使羰基電子云密度平均化,從而使伸縮振動頻率降低,證明了 PCL 與 QAS 之間確實存在著強相互作用。
為證實明膠與 QAS 之間的作用,用 QAS 的良溶劑甲醇清洗納米纖維膜來去除纖維膜中以物理共混狀態存在的 QAS,當清洗后的溶液中經 FTIR 檢測無殘留 QAS 后,對清洗后的纖維膜進行 FTIR 表征(見圖 3d),結果表明在 2 946、2 868 cm–1處仍然出現 QAS 長鏈烷烴中的 CH3 和 CH2 振動峰,1 088 cm–1處出現 Si-O-Si 基團,證明 QAS 和明膠之間發生了化學交聯反應,QAS 化學鍵合在聚合物基體上。此外,QAS 分子間相互作用脫水縮合也能形成 Si-O-Si 鍵,能夠在材料表面形成一層 Si-O-Si 的抗菌網絡層,并且由于 Si-O 鍵能高因而性質穩定,不易從基體上脫落,因此賦予了材料持久長效的抗菌效果。這種特殊的結構使得 PG-Q 膜與現有臨床應用較多的含銀離子的抗菌敷料相比,更能長期有效地抑制殺滅細菌。
2.3 親水性
纖維膜表面 WCA 結果如圖 4 所示,隨著 QAS 含量從 0% 增至 20%,纖維膜表面 WCA 逐漸增大,分別是 100.12°、104.47°、112.23°、118.84°、122.66°,說明膜的疏水性增大。這一結果是由于 QAS 中含有疏水性很強的十八烷基,其與紡絲基體結合后使纖維親水性下降。由于疏水的纖維表面不利于纖維細胞的附著,因此可以防止傷口部位與敷料之間發生粘連,更換敷料時就不會引起患者的二次創傷,從而有利于傷口的愈合。
 圖4
不同 QAS 含量的納米纖維膜表面 WCA 變化
Figure4.
The WCA images of nanometer fiber membranes containing different QAS components
圖4
不同 QAS 含量的納米纖維膜表面 WCA 變化
Figure4.
The WCA images of nanometer fiber membranes containing different QAS components
2.4 細胞毒性試驗
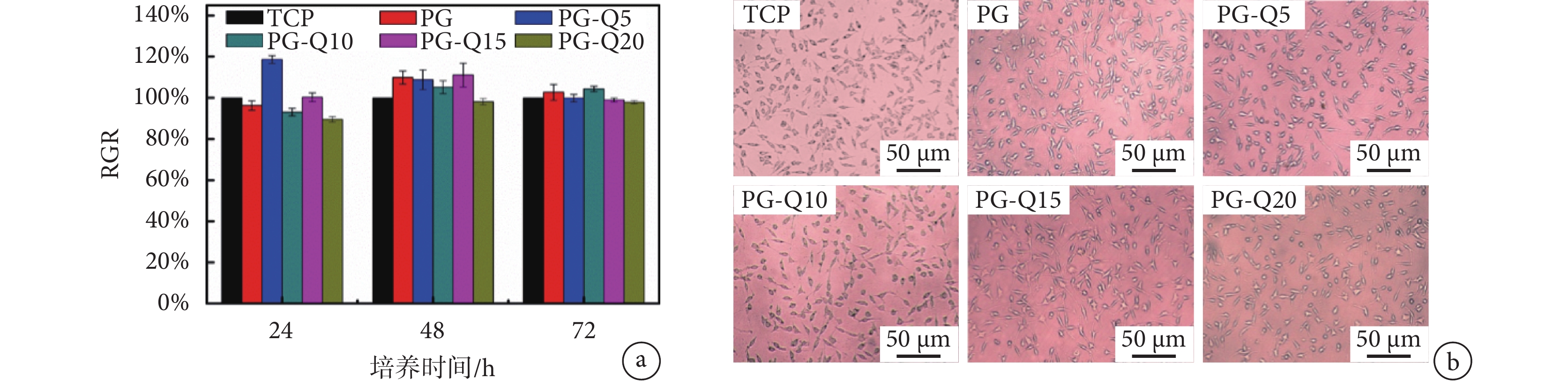
如圖 5b 所示,將 L929 細胞與纖維膜的浸提液共培育 24、48、72 h 后,L929 細胞基本呈現出梭形、三角形及長方形,具有良好的生長狀態,且隨著時間延長細胞呈現良好的增殖狀態。圖 5a 表明 48、72 h 后,所有載藥型 L929 細胞的 RGR 均接近甚至高于 100%,對照組和各實驗組之間以及含不同 QAS 的 PG-Q 納米纖維膜之間的 RGR 均無明顯差異(P > 0.05),即使 QAS 含量增至 20%,實驗組和空白組的細胞增殖、分化程度仍相似,實驗組材料培育的細胞 RGR 均在 95% 以上。這一結果證實 QAS 的加入以及紡絲過程中溶劑的使用均不影響材料的細胞毒性,該 PG-Q 膜具有良好的細胞親和性。
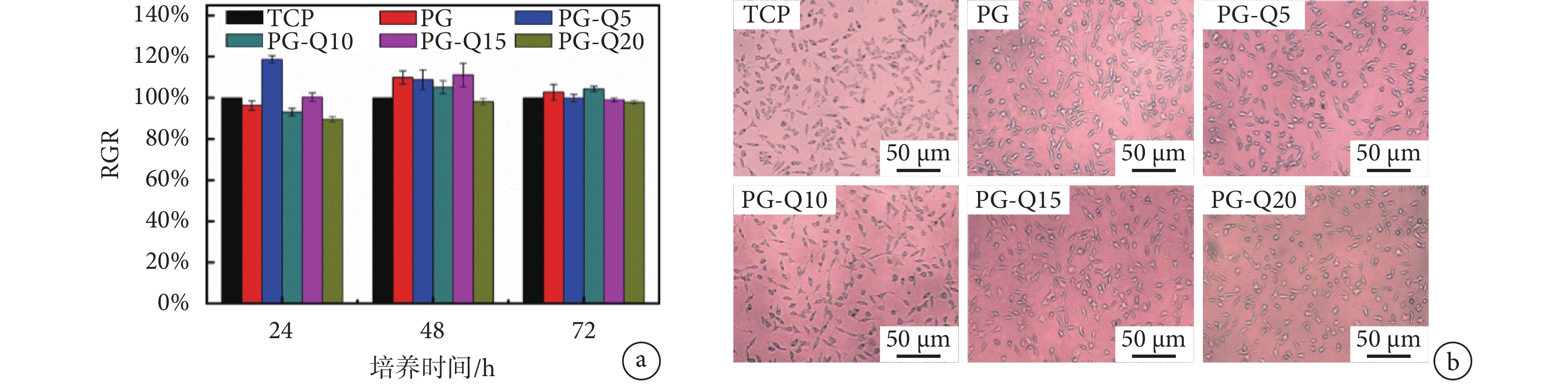 圖5
不同 QAS 含量的 PG-Q 膜的細胞毒性
圖5
不同 QAS 含量的 PG-Q 膜的細胞毒性
a.細胞 RGR;b.細胞熒光照片
Figure5. The cytotoxicity of the PG-Q membranes containing different QAS componentsa. the RGR results; b. fluorescent photographs of cells
2.5 體外抑菌性能
將 PG-Q 納米纖維膜與菌種培育不同時間后進行平板計數,菌落增殖照片如圖 6 所示。PG-Q 納米纖維膜的抑菌性源自于 QAS 上帶正電荷的 N+陽離子,其可通過靜電力吸引帶負電荷的細菌,破壞細菌菌膜上的電荷平衡,使細菌內容物泄露,從而達到抑菌殺菌的效果。不含 QAS 的 PG 膜與金黃色葡萄球菌共培育 3、6、12 h 后,始終未表現出抑菌性。而含 QAS 的 PG-Q 纖維膜均表現出抑菌性,且抑菌率隨 QAS 含量的增加而逐漸增大。其中 PG-Q15 和 PG-Q20 與金黃色葡萄球菌共培育 3 h 后,抑菌率就分別達到 61.37% 和 72.67%,6 h 后均可殺滅 99.99% 的金黃色葡萄球菌。因此我們選擇 PG-Q15 和 PG-Q20 作為革蘭陰性菌的抑菌試驗對象。PG-Q15 和 PG-Q20 與綠膿桿菌共培育 3 h 后的抑菌率分別為 47.20% 和 51.71%,培育時間 6 h 時抑菌率分別為 68.41% 和 90.37%,培育 12 h 后抑菌率達 99.51% 和 99.88%。因此 PG-Q 膜對革蘭陽性及革蘭陰性菌均有良好的抑菌效果,且對革蘭陽性菌的抑菌作用更明顯。
本研究首次將有機硅季銨鹽 QAS 用于制備抗菌敷料的研究,PG-Q 膜不僅對于導致傷口感染的常見細菌具有明顯的抗菌效果,同時也具有相對快速的殺菌速率。由于銀離子敷料存在安全隱患,該 PG-Q 膜具有補充并替代現有抗菌敷料的發展潛力。
 圖6
金黃色葡萄球菌及綠膿桿菌在不同 QAS 含量的 PG-Q 膜上的生長情況
Figure6.
The CFU photograph of S. aureus and P. aeruginosa on electrospun PG-Q membranes containing different QAS components
圖6
金黃色葡萄球菌及綠膿桿菌在不同 QAS 含量的 PG-Q 膜上的生長情況
Figure6.
The CFU photograph of S. aureus and P. aeruginosa on electrospun PG-Q membranes containing different QAS components
3 結論
本研究采用 QAS 來改性 PCL-明膠復合材料,通過靜電紡絲法制備出不同 QAS 含量的具有微納結構的纖維膜。結果表明 QAS 的加入能夠促進 PCL 與明膠的相分離,還能提高膜的憎水性,有利于膜與傷口的剝離。QAS 與 PCL-明膠之間存在著物理和化學交聯作用,有助于 QAS 發揮長效抑菌作用。此外,QAS 的加入對于細胞毒性以及細胞在膜上的黏附及增殖沒有顯著影響。QAS 含量為 15 wt% 及 20 wt% 的樣品對金黃色葡萄球菌及綠膿桿菌都有明顯的抑制作用。通過添加 QAS 抗菌劑,賦予了靜電紡絲納米纖維膜以廣譜抗菌的特點,且 QAS 通過化學交聯作用與紡絲基體結合在一起,具有非水溶性、不會隨著體液循環進入人體內部以及長期抗菌的優點。此外,相比于負載抗生素等載藥納米纖維膜,PG-Q 膜的陽離子接觸式殺菌機制不會引起菌種耐藥性。綜上所述,PG-Q15 和 PG-Q20 纖維膜具有作為抑菌型傷口敷料的臨床應用潛能。
引言
皮膚對于病原體具有天然的屏障作用,大量文獻報道傷口破損容易引發病原體在創面的聚集從而造成傷口感染[1]。一旦發生難愈合的傷口感染,將會給患者造成極大的痛苦以及醫療負擔[2]。因此,制備抗感染的傷口敷料對于保護傷口以及抑制傷口感染具有極其重要的意義。
傷口敷料具有吸收滲出液、防止水分流失以及防止細菌侵入傷口的作用。利用抗菌型敷料對感染傷口進行處理可以提高細胞內皮化速率及促進傷口愈合[3]。溶出型抗菌敷料的抑菌原理是在基體材料中加載一種或多種抑菌劑,如抗生素[4-6]、銀納米粒子[7-9]及季銨鹽(trimethoxysilylpropyl octadecyldimethyl ammonium chloride,QAS)[10]等,抑菌物質逐漸溶出釋放到敷料周圍從而殺滅細菌。然而,基于藥物釋放的溶出型傷口敷料存在一些缺陷,如:① 隨著藥物的釋放,敷料的機械性能下降且完整性被破壞;② 藥物釋放時間短且難以控制;③ 難以做到可控釋放,短暫大量突釋會對周圍組織產生毒性。而非溶出型敷料卻可以克服以上不足,從而達到長效持久抑菌的效果。
QAS 具有廣譜抑菌效果及高效抑菌活力,能夠有效殺滅革蘭陽性菌、革蘭陰性菌及真菌。QAS 是一種具有雙官能團的新型有機硅季銨鹽,該季銨鹽分子結構中含有一個硅氧鍵,能夠在溫和的條件下與羥基發生反應;此外,其長鏈烷基上含有帶正電荷的季銨基團能夠提供抑菌活性[11]。據文獻報道,QAS 可能的抗菌機制有兩種:QAS 表面的陽離子基團與細菌膜表面的負電荷發生反應,導致細菌膜表面電荷分散不均從而造成膜破裂和細菌死亡;長鏈烷基穿透細菌膜進入細菌內部從而改變細菌膜的理化性能,引發細菌內容物泄漏從而殺滅細菌[12]。
目前,QAS 已經作為消毒材料被廣泛應用于紡織工業、醫療消毒以及包裝材料。QAS 還被用于二氧化硅納米粒子的表面改性且表現出優異的抗菌性能[13]。Andresen 等[14]利用 QAS 通過簡單的吸收-固化法改性了纖維素膜表面,并指出該改性的纖維素膜對于傷口修復具有良好的效果。許多天然及人工合成高分子材料表面含有大量羥基和羧基,隨著溫度升高,大多能與 QAS 上的硅氧鍵發生反應并將 QAS 以化學鍵結合在膜表面,從而在基體表面形成一種抑菌的網絡結構。并且,Si-O-Si 基團的穩定性很強,因而能夠實現長效抑菌的功效。
靜電紡絲是最直接有效制備微納尺度纖維膜的方法。由于靜電紡絲膜具有高比表面積、貫穿孔以及高孔隙率,因此非常適合作為傷口敷料用來止血、透氣、保持水分及排出滲出液。與其他常見可降解高分子材料比較,如膠原、聚乳酸及聚乙醇酸等,聚己內酯[poly(ε-caprolactone),PCL]具有無免疫原性、降解過程不產生酸堆積、生物相容性好、柔韌性強、力學強度高、共混相容性好等諸多優點,使其在生物醫用領域有著廣泛的應用[15]。因此,本研究擬采用 PCL 作為基體材料制備纖維膜。但是由于 PCL 在體內的吸收時間為 2~3 年[16],這對于可吸收隔離膜來說過于緩慢。此外,PCL 屬于疏水性聚合物,不利于細胞黏附。因此,為了改善 PCL 的降解性能及生物相容性,需要將 PCL 與其他降解速率快且親水性能好的聚合物共混或共聚。明膠是膠原的水解產物,不但降解吸收速率快、無免疫原性,而且明膠分子上保留了大量有助于細胞黏附、分化及增殖的氨基酸序列[17],因此,本研究選用明膠與 PCL 共混制備復合納米纖維膜從而提高膜的相容性及降解速率。
本研究通過 QAS 改性 PG 復合材料,再通過靜電紡絲技術將該復合材料(PG-Q)制備成納米纖維膜,從而獲得一種非溶出廣譜抑菌且接觸式殺菌型傷口敷料。本文研究了 QAS 的加入對于膜形態、表面親水、抑菌活性以及細胞相容性的影響,將為制備新型的非溶出型抑菌敷料奠定基礎。
1 試劑和方法
1.1 原料、試劑和主要儀器
QAS 購自英國 Fluorochem 公司;PCL(Mn = 70~90 kD)、明膠及 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽購自德國 Sigma-Aldrich 公司;四氟乙烯(tetrafluoroethylene,TFE)(純度 99.8%)購自美國 Aladdin 公司;標準型光學接觸角測定儀(SL200A)購自中國上海賽龍科技有限公司;掃描電子顯微鏡(scanning electron microscopy,SEM,Hitachi S-4700)、透射電子顯微鏡(transmission electron microscopy,TEM,JEM-2100F)購自日本日立公司。
1.2 靜電紡絲膜的制備
PCL-明膠(PG)溶液的配置是將 6 wt% 的 PCL/TFE 與 6 wt% 的明膠/TFE 以 70∶30 的質量比混合。將 PCL 與明膠總質量 5~20% 的 QAS 添加至 PG 溶液中。所有的溶液在 60℃ 下磁力攪拌 12 h。紡絲液擠出速率為 1.3 mL/h,電壓 8~20 kV,接收鋁箔滾筒轉速為 300 r/min。接收滾筒距離為 20 cm,樣品 PG、PG-Q5、PG-Q10、PG-Q15、PG-Q20 分別表示 QAS 含量占聚合物質量的 0%、5%、10%、15% 及 20%。
1.3 表面形貌及纖維形貌
用 SEM 對樣品 PG、PG-Q5、PG-Q10、PG-Q15、PG-Q20 的表面形貌進行形態觀察。再用去離子水將膜反復清洗后,得到樣品 PG’、PG-Q5’、PG-Q10’、PG-Q15’、PG-Q20’,再次用 SEM 觀察膜的表面形貌。膜表面經過噴金處理。掃描電壓 20 kV。
TEM 用來觀察紡絲纖維的結構,觀察樣品為 PG-Q10。測試電壓 200 kV,暗電流 95 μA,發射束流 126 μA。
1.4 化學結構
傅里葉紅外測試(Fourier transform infrared,FTIR)用來研究用于電紡絲的復合材料中各組分間(PCL、明膠及 QAS)的相互作用。采用 Bruker Tensor 27 分光儀,掃描范圍是 400~4 000 cm–1,分辨率為 2 cm–1。測試樣品分為:(a)不同季銨鹽組分的納米纖維膜(PG、PG-Q5、PG-Q10、PG-Q15、PG-Q20);(b)單一組分(PCL、明膠、QAS);(c)PCL 與 PCL-QAS 復合材料;(d)明膠與明膠-QAS。
1.5 靜態接觸角
使用 SL200A-標準型光學接觸角測定儀測量膜的靜態接觸角(water contact angle,WCA)。測試樣品為含有不同季銨鹽組分的納米纖維膜 PG、PG-Q5、PG-Q10、PG-Q15、PG-Q20。拍照時間點分別為 0、1、2、5 及 10 s。
1.6 細胞毒性試驗
為了檢測有機硅季銨鹽以及材料中的有機溶劑對細胞毒性的影響,我們采用四甲基偶氮唑藍(methyl thiazolyl tetrazolium,MTT)法來測試細胞毒性。
材料浸提液的制備:將大小 20 mm × 30 mm 的樣品,用 75%(v/v)酒精清洗后按照 3 cm2/mL 浸泡在 37℃ 的 DMEM 中 24 h,再通過孔徑 0.22 μm 的過濾器過濾獲得測試樣品的浸提液。
測試材料的分組情況分別為:組織培養板(tissue culture plate,TCP)以及含不同質量百分比的季銨鹽的樣品 PG、PG-Q5、PG-Q10、PG-Q15、PG-Q20。
MTT 法檢測細胞毒性:用 96 孔板培養小鼠成纖維細胞 L929,接種細胞濃度為 5 × 104/mL,24 h 后吸去培養液,加入等量材料浸提液,陰性對照用含有 10% 胎牛血清(fetal bovine serum,FBS)的 DMEM 培養液,分別于 24、48 及 72 h,經 5 mg/mL MTT 和酸化異丙醇處理后,用酶聯儀在 630 nm 波長測其吸光度值,取平均值。計算細胞相對增殖率(relative growth rate,RGR):RGR =(試樣 OD 值 – 空白 OD 值)/(陰性 OD 值 – 空白 OD 值)。
1.7 抑菌性能
依據 GB15979-2002 國家標準《一次性使用衛生用品衛生標準》和接觸性創面敷料試驗方法,采用非溶出性抗菌產品抑菌性能動態搖瓶法來測定納米纖維膜的抑菌性。菌種選用臨床上易引起傷口感染的兩種常見菌:金黃色葡萄球菌和綠膿桿菌。設置不同 QAS 含量的 PG-Q(PG-Q5、PG-Q10、PG-Q15、PG-Q20)納米纖維膜與菌種共培養作為實驗組,PG 膜與菌種共培養作為材料對照組,空白組為單獨菌種培育。
將細菌培養于溶原性肉湯(lysogeny broth,LB)溶液中,置于 37℃ 恒溫搖床中培養 24 h。此后再將兩種菌液各 1 mL 轉移至含 50 mL 新鮮 LB 溶液的燒瓶中。37℃ 恒溫搖床中再培養 5 h,從而獲得細菌懸液。此后,將兩種細菌的懸液用無菌生理鹽水稀釋到 1 × 106 CFU/mL(CFU:菌落形成單位,colony-forming units)。將直徑為 2 cm2的膜浸在 10 mL 細菌懸液(含 1 mL 細菌懸液和 9 mL 生理鹽水)并置于密閉容器中,再將容器置于 37℃、170 r/min 的恒溫搖床中分別培養 3、6 及 12 h。在預設時間點將 100 μL 的 10 倍稀釋菌液加入瓊脂板上。瓊脂板在 37℃ 下孵育 12 h,觀察細菌的增殖。最后,對 CFU 計數,計算細菌殺死率。
1.8 統計學處理
所有的實驗數據以均值 ± 標準誤表示,采用 SPSS 17.0 軟件對實驗結果進行統計學分析,兩組間比較采用 t 檢驗,多組間比較采用方差分析。P < 0.05 認為差異具有統計學意義。
2 結果與討論
2.1 表面形貌
靜電紡絲納米纖維膜的 SEM 圖像如圖 1 所示。與未加入 QAS 的 PG 膜相比,含 QAS 的 PG-Q 納米纖維膜結構完整,纖維表面光滑連續,無串珠形成。這是由于帶正電荷的 QAS 加入后,三甲氧基硅烷基團水解形成的硅羥基與 PCL 和明膠分子鏈上的羥基、羧基等發生脫水縮合,從而將帶正電的季銨鹽基團鍵合在紡絲基體上。
 圖1
水洗前及水洗后不同 QAS 含量的 PG-Q 靜電紡絲膜的掃描電鏡圖片
圖1
水洗前及水洗后不同 QAS 含量的 PG-Q 靜電紡絲膜的掃描電鏡圖片
黑色箭頭表示亞網絡結構
Figure1. The SEM images of the electrospun nanofibrous membranes containing different QAS components before and after washed with ultrapure waterthe black arrows showed the subnet structure
當電場中電壓足夠強時,帶電射流會在電壓作用下進一步延伸為單獨的纖維或分絲成幾根纖維。如圖 1 中箭頭所示,在 PG-Q5 和 PG-Q10 中存在少量的纖維直徑在 10 nm 以下的亞網絡結構纖維。我們推斷這種亞網絡結構是由于紡絲過程中明膠的相分離形成的。而當季銨鹽含量高于 15% 時,亞網絡結構消失,但出現直徑為數十納米的超細纖維。
為了證實這種亞網絡結構的主要成分是分相后的明膠,我們對去離子水反復清洗后的納米纖維膜進行了 SEM 表征,結果表明水洗后的納米纖維膜中亞網絡結構消失,但纖維膜的整體形貌未發生明顯改變,該結果側面證實亞網絡結構的主要成分為易溶于水的明膠,而疏水的 PCL 則有利于纖維形貌結構保持完整。
如表 1 所示,隨著 QAS 含量的增多,纖維直徑及其分布都有所增大,水洗后纖維輕微溶脹,直徑略有增加但直徑分布變窄。纖維直徑分布變窄是由于亞網絡結構消失,纖維直徑趨于均一化,這也從另一方面證實了亞網絡結構是由具有良好親水性的明膠分相后形成的。
對 PG-Q10 進行 TEM 觀察(見圖 2),可以清晰地看到纖維內部出現相分離結構,由于密度和襯度不同,纖維內層顏色較深的為 PCL,纖維外部顏色較淺的為明膠,這與圖 1 中 PG-Q5 和 PG-Q10 中出現的亞網絡結構相對應,再一次證實了亞網絡結構是由明膠分相后形成的。
 圖2
QAS 質量分數為 10% 的 PG-Q10 樣品的 TEM 圖片
Figure2.
The TEM image of the PG-Q10 containing 10 wt% QAS
圖2
QAS 質量分數為 10% 的 PG-Q10 樣品的 TEM 圖片
Figure2.
The TEM image of the PG-Q10 containing 10 wt% QAS
此外,從圖 1 中可見不同樣品納米纖維膜的孔徑為 0.5~4 μm,遠小于臨床現有敷料的孔徑,從而能夠更有效地阻止細菌的透過,同時還有利于氣體的交換。
2.2 不同組分間相互作用
 圖3
不同樣品紅外譜圖的對比
圖3
不同樣品紅外譜圖的對比
a.含有不同季銨鹽組分的納米纖維膜;b.單一組分;c. PCL 與 PCL-QAS 復合材料;d.明膠與明膠-QAS 復合材料
Figure3. Infrared spectrums of different samplesa. nanometer fiber membranes containing different QAS components; b. single component; c. PCL and PCL-QAS composites; d. gelatin and gelatin-QAS composites
圖 3a 是含有不同 QAS 組分的有機硅季銨鹽聚己內酯明膠納米纖維膜的紅外譜圖。如圖 3b 所示,PCL 的紅外譜圖中,2 800~2 900 cm–1是 CH3 和 CH2 的伸縮振動峰,1 725 cm–1是羰基峰;1 650、1 550 cm–1是明膠中酰胺Ⅰ和酰胺Ⅱ鍵(1 650 cm–1是酰胺Ⅰ鍵,反對稱-COOH 或 C=O 振動;1 550 cm–1為酰胺Ⅱ鍵,C-N 伸縮或 N-H 彎曲振動);1 088 cm–1是 QAS 中的 Si-O 鍵。
如圖 3c 所示,PCL 譜圖中 1 725 cm–1中的 C=O 伸縮振動峰在加入 QAS 后向 1 647 cm–1低波數偏移,是由于硅羥基和羰基酯鍵形成氫鍵,使羰基電子云密度平均化,從而使伸縮振動頻率降低,證明了 PCL 與 QAS 之間確實存在著強相互作用。
為證實明膠與 QAS 之間的作用,用 QAS 的良溶劑甲醇清洗納米纖維膜來去除纖維膜中以物理共混狀態存在的 QAS,當清洗后的溶液中經 FTIR 檢測無殘留 QAS 后,對清洗后的纖維膜進行 FTIR 表征(見圖 3d),結果表明在 2 946、2 868 cm–1處仍然出現 QAS 長鏈烷烴中的 CH3 和 CH2 振動峰,1 088 cm–1處出現 Si-O-Si 基團,證明 QAS 和明膠之間發生了化學交聯反應,QAS 化學鍵合在聚合物基體上。此外,QAS 分子間相互作用脫水縮合也能形成 Si-O-Si 鍵,能夠在材料表面形成一層 Si-O-Si 的抗菌網絡層,并且由于 Si-O 鍵能高因而性質穩定,不易從基體上脫落,因此賦予了材料持久長效的抗菌效果。這種特殊的結構使得 PG-Q 膜與現有臨床應用較多的含銀離子的抗菌敷料相比,更能長期有效地抑制殺滅細菌。
2.3 親水性
纖維膜表面 WCA 結果如圖 4 所示,隨著 QAS 含量從 0% 增至 20%,纖維膜表面 WCA 逐漸增大,分別是 100.12°、104.47°、112.23°、118.84°、122.66°,說明膜的疏水性增大。這一結果是由于 QAS 中含有疏水性很強的十八烷基,其與紡絲基體結合后使纖維親水性下降。由于疏水的纖維表面不利于纖維細胞的附著,因此可以防止傷口部位與敷料之間發生粘連,更換敷料時就不會引起患者的二次創傷,從而有利于傷口的愈合。
 圖4
不同 QAS 含量的納米纖維膜表面 WCA 變化
Figure4.
The WCA images of nanometer fiber membranes containing different QAS components
圖4
不同 QAS 含量的納米纖維膜表面 WCA 變化
Figure4.
The WCA images of nanometer fiber membranes containing different QAS components
2.4 細胞毒性試驗
如圖 5b 所示,將 L929 細胞與纖維膜的浸提液共培育 24、48、72 h 后,L929 細胞基本呈現出梭形、三角形及長方形,具有良好的生長狀態,且隨著時間延長細胞呈現良好的增殖狀態。圖 5a 表明 48、72 h 后,所有載藥型 L929 細胞的 RGR 均接近甚至高于 100%,對照組和各實驗組之間以及含不同 QAS 的 PG-Q 納米纖維膜之間的 RGR 均無明顯差異(P > 0.05),即使 QAS 含量增至 20%,實驗組和空白組的細胞增殖、分化程度仍相似,實驗組材料培育的細胞 RGR 均在 95% 以上。這一結果證實 QAS 的加入以及紡絲過程中溶劑的使用均不影響材料的細胞毒性,該 PG-Q 膜具有良好的細胞親和性。
 圖5
不同 QAS 含量的 PG-Q 膜的細胞毒性
圖5
不同 QAS 含量的 PG-Q 膜的細胞毒性
a.細胞 RGR;b.細胞熒光照片
Figure5. The cytotoxicity of the PG-Q membranes containing different QAS componentsa. the RGR results; b. fluorescent photographs of cells
2.5 體外抑菌性能
將 PG-Q 納米纖維膜與菌種培育不同時間后進行平板計數,菌落增殖照片如圖 6 所示。PG-Q 納米纖維膜的抑菌性源自于 QAS 上帶正電荷的 N+陽離子,其可通過靜電力吸引帶負電荷的細菌,破壞細菌菌膜上的電荷平衡,使細菌內容物泄露,從而達到抑菌殺菌的效果。不含 QAS 的 PG 膜與金黃色葡萄球菌共培育 3、6、12 h 后,始終未表現出抑菌性。而含 QAS 的 PG-Q 纖維膜均表現出抑菌性,且抑菌率隨 QAS 含量的增加而逐漸增大。其中 PG-Q15 和 PG-Q20 與金黃色葡萄球菌共培育 3 h 后,抑菌率就分別達到 61.37% 和 72.67%,6 h 后均可殺滅 99.99% 的金黃色葡萄球菌。因此我們選擇 PG-Q15 和 PG-Q20 作為革蘭陰性菌的抑菌試驗對象。PG-Q15 和 PG-Q20 與綠膿桿菌共培育 3 h 后的抑菌率分別為 47.20% 和 51.71%,培育時間 6 h 時抑菌率分別為 68.41% 和 90.37%,培育 12 h 后抑菌率達 99.51% 和 99.88%。因此 PG-Q 膜對革蘭陽性及革蘭陰性菌均有良好的抑菌效果,且對革蘭陽性菌的抑菌作用更明顯。
本研究首次將有機硅季銨鹽 QAS 用于制備抗菌敷料的研究,PG-Q 膜不僅對于導致傷口感染的常見細菌具有明顯的抗菌效果,同時也具有相對快速的殺菌速率。由于銀離子敷料存在安全隱患,該 PG-Q 膜具有補充并替代現有抗菌敷料的發展潛力。
 圖6
金黃色葡萄球菌及綠膿桿菌在不同 QAS 含量的 PG-Q 膜上的生長情況
Figure6.
The CFU photograph of S. aureus and P. aeruginosa on electrospun PG-Q membranes containing different QAS components
圖6
金黃色葡萄球菌及綠膿桿菌在不同 QAS 含量的 PG-Q 膜上的生長情況
Figure6.
The CFU photograph of S. aureus and P. aeruginosa on electrospun PG-Q membranes containing different QAS components
3 結論
本研究采用 QAS 來改性 PCL-明膠復合材料,通過靜電紡絲法制備出不同 QAS 含量的具有微納結構的纖維膜。結果表明 QAS 的加入能夠促進 PCL 與明膠的相分離,還能提高膜的憎水性,有利于膜與傷口的剝離。QAS 與 PCL-明膠之間存在著物理和化學交聯作用,有助于 QAS 發揮長效抑菌作用。此外,QAS 的加入對于細胞毒性以及細胞在膜上的黏附及增殖沒有顯著影響。QAS 含量為 15 wt% 及 20 wt% 的樣品對金黃色葡萄球菌及綠膿桿菌都有明顯的抑制作用。通過添加 QAS 抗菌劑,賦予了靜電紡絲納米纖維膜以廣譜抗菌的特點,且 QAS 通過化學交聯作用與紡絲基體結合在一起,具有非水溶性、不會隨著體液循環進入人體內部以及長期抗菌的優點。此外,相比于負載抗生素等載藥納米纖維膜,PG-Q 膜的陽離子接觸式殺菌機制不會引起菌種耐藥性。綜上所述,PG-Q15 和 PG-Q20 纖維膜具有作為抑菌型傷口敷料的臨床應用潛能。