引用本文: 劉勃實, 東莉潔, 黃亮瑜, 黃欣遠, 劉勛, 王瓊, 洪雅茹, 韓金棟, 李筱榮. 氧誘導視網膜病變小鼠視網膜組織中miRNA的表達及分析. 中華眼底病雜志, 2020, 36(7): 544-550. doi: 10.3760/cma.j.cn511434-20191105-00361 復制
視網膜新生血管(RNV)性疾病是導致各個年齡段視覺障礙的主要原因。異常增生的新生血管通過多種途徑以及多種因子的調節[1-2]。近年來,隨著對miRNA研究的不斷深入,多種miRNA在眼部的表達及其在RNV性疾病中調節新生血管生成的作用已被發現[3-4]。如miRNA-329和miRNA-191顯著抑制新生血管形成;miRNA370可通過上調p21的表達,抑制血管內皮細胞生長,進而抑制新生血管生成[5-7]。本研究擬通過miRNA芯片檢測分析挖掘氧誘導視網膜病變(OIR)模型小鼠視網膜組織中較正常小鼠視網膜組織表達具有顯著差異的miRNA并輔以后續的驗證,為今后尋找抑制RNV的新靶點提供理論依據。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
7日齡C57BL/6J小鼠80只,清潔級,平均體重(3.53±0.37)g,雌雄不限,由斯貝福(北京)生物技術有限公司提供。飼養環境及實驗操作均符合國家科學技術委員會《實驗動物管理條例》的規定,并獲得天津醫科大學眼科醫院動物倫理委員會許可(倫理編號:TJYY20190103002)。80%氧氣和20%氮氣混合氣體(天津市華氧液化空氣制品有限公司),解剖顯微鏡(美國Zeiss公司),病理切片機RM2165(德國Leica公司),包埋機EG1160(德國Leica公司),熒光顯微鏡(日本Nikon公司),異硫氰酸熒光素葡聚糖(美國Sigma公司)。
1.2 實驗方法
采用隨機數字表法將小鼠分為對照組、OIR組,每組40只。OIR組小鼠參照文獻[3]的方法構建OIR模型,將小鼠置于含氧氣濃度為(75±2)%的飼養箱中,溫度維持在(23±2)℃,氧氣分析儀監測并調控飼養箱內的氧氣含量。對照組小鼠不做任何處理。
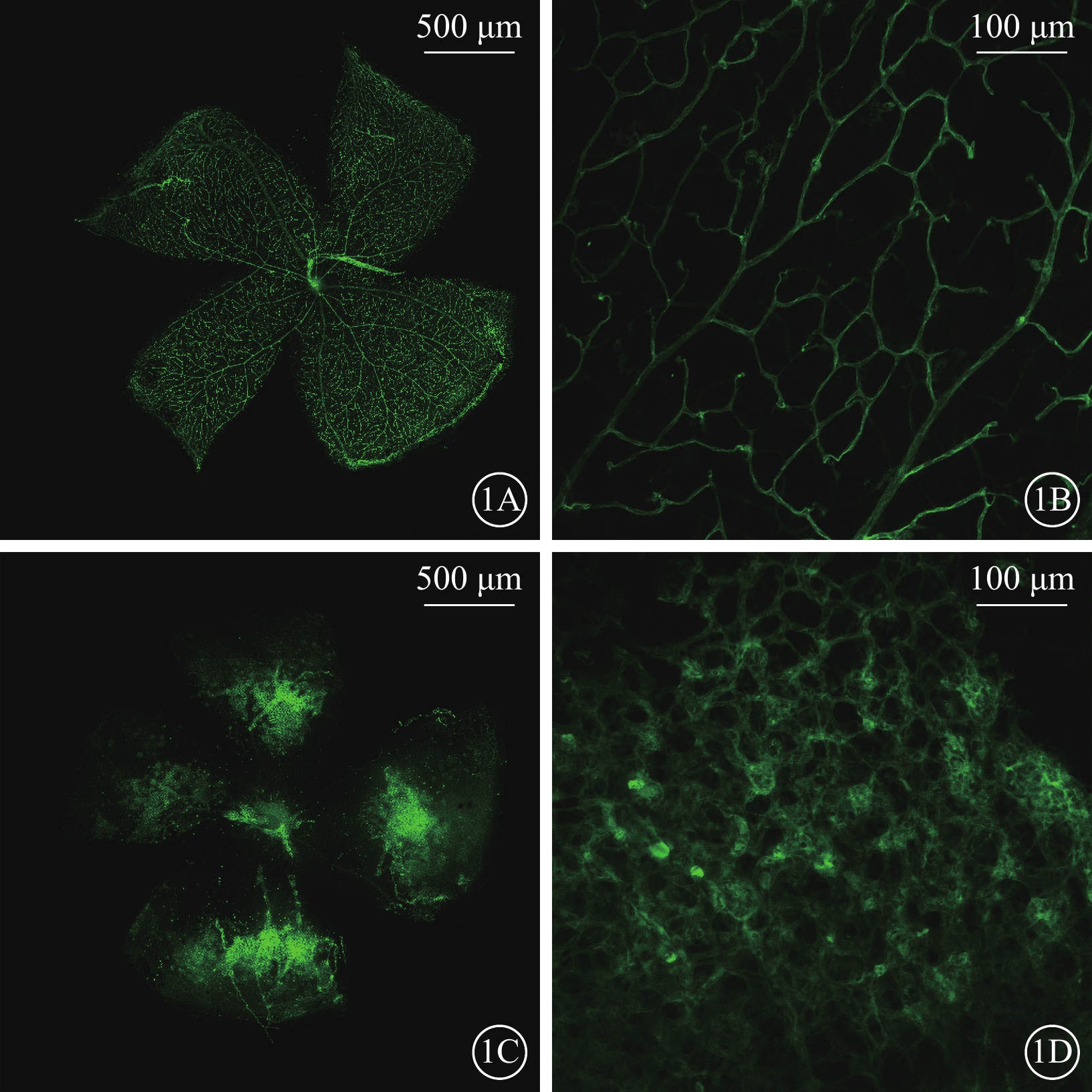
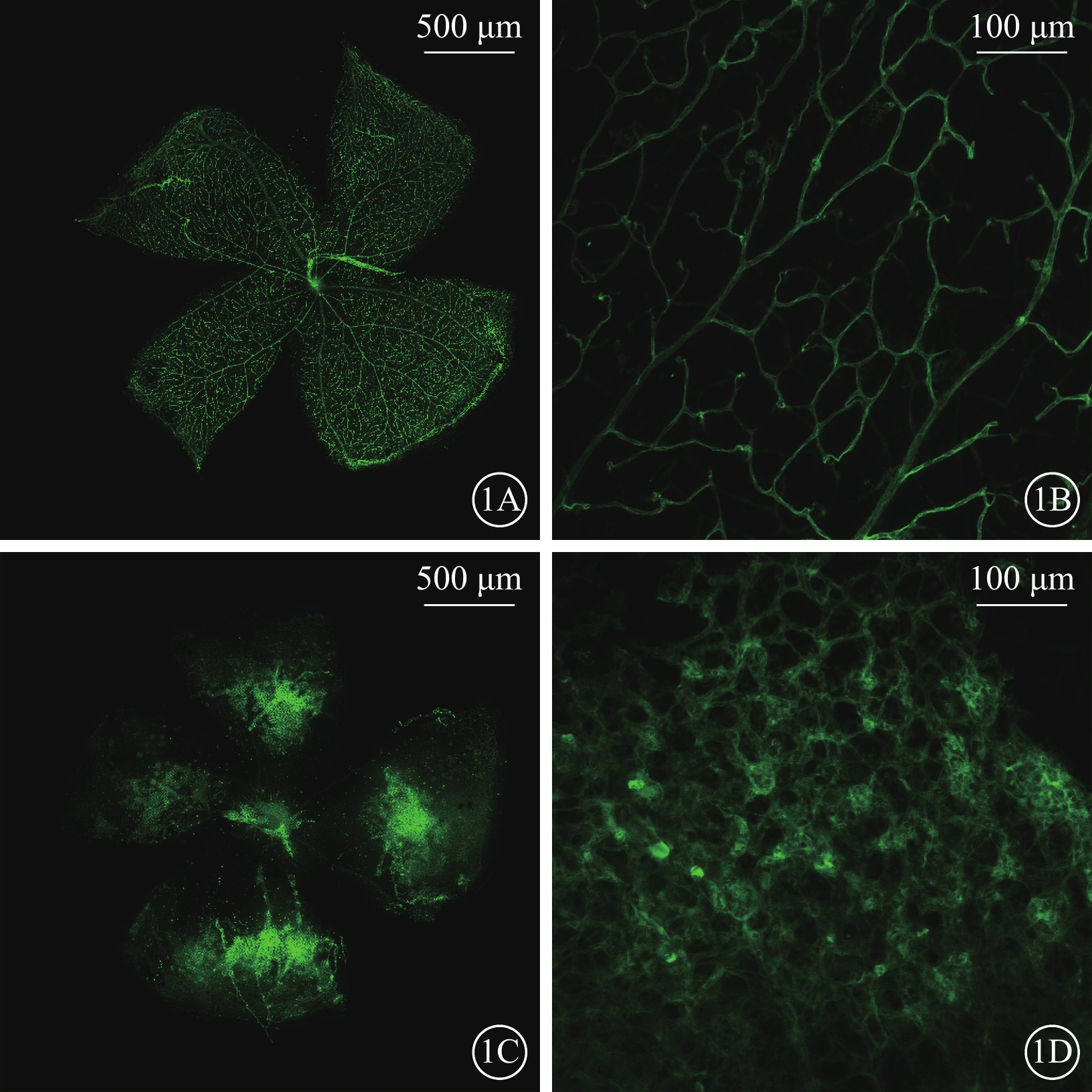
小鼠17日齡時,每組取5只小鼠腹腔注射過量10%水合氯醛處死。摘取眼球,4%多聚甲醛室溫固定1 h,之后將眼球放入PBS(pH7.4)中4 ℃保存。手術顯微鏡下剝離完整的視網膜,并于4 ℃過夜固定。參照文獻[4]的方法對視網膜血管進行染色,染色后的標本以節細胞層向上平鋪于載玻片上,含DAPI的抗熒光衰退封片劑封片。熒光顯微鏡下采用與文獻[4]相同的光學參數拍照。
小鼠17日齡時,每組取5只小鼠腹腔注射過量10%水合氯醛處死。摘除眼球,標記方向后立即置于4%多聚甲醛中4 °C過夜,次日,常規脫水、透明、浸蠟,石蠟包埋,矢狀面平行視神經進行連續切片,片厚5 μm,每片相隔30 μm,去掉有視神經的切面。每只眼球選取10個切片,常規脫蠟后行HE染色。雙盲法統計每張切片中突破視網膜內界膜的血管內皮細胞核數目,同時排除玻璃體腔與視網膜內界膜無聯系的血管內皮細胞核。
小鼠17日齡時,每組取30只小鼠腹腔注射過量10%水合氯醛處死。摘除眼球,取視網膜組織立即放入液氮中,并放入-80 ℃冰箱中。其中20只小鼠眼球視網膜標本由北京霖源生物科技有限公司行基因芯片分析;另外10只小鼠眼球在取得miRNA基因芯片結果后采用逆轉錄(RT)-PCR驗證芯片檢測差異倍數最高的5個miRNA。將眼球組織放入勻漿器混勻,加入勻漿添加劑冰上勻漿10 min。1 ml裂解液中加入200 μl氯仿,渦旋30 s,以離心半徑15 cm、轉速12 000 r/min離心5 min,取上清液置于新管中,記錄體積;加入1.25倍體積的100%乙醇,渦旋混勻,反復過純化柱,以離心半徑15 cm、轉速12 000 r/min離心15 s;將離心柱放置到新的收集管中,柱中心加入100 μl 95 °C預熱的洗脫液,室溫條件下,以離心半徑15 cm、轉速12 000 r/min離心30 s,收集管中液體即為提取的Total RNA,Nanodrop 2000分光光度計測定miRNA的含量和純度,-80 ℃保存待用。利用miScript Ⅱ Reverse Transcription Kit(德國Qiagen公司)逆轉miRNA并行PCR反應。按說明書中的反應體系和操作步驟進行逆轉。利用Green PCR Kit試劑盒(德國Qiagen公司)在LightCycler 480 Ⅱ型熒光定量PCR儀(瑞士Roche公司)上進行反應。參數:37 ℃孵育60 min,85 ℃變性5 min。合成的cDNA于-80 ℃保存備用。cDNA經5倍稀釋后與正反向引物一起進行RT-PCR反應。引物設計來源于天津深藍易源生物科技有限公司,由北京擎科新業生物技術有限公司合成。miR-7080-5p:GTAGGAGCTGGAGGTGGGTT;miR-6401:TTACACTCCAGTGGTGTCGG;miR-299b-3p:TATGTGGGACGGTAAACCAA;miR-3470a:TCACTTTGTAGACCAGGCTG;miR-129-2-3p:AAGCCCTTACCCCAAAAAGCA,序列均為5'-3'。RT-PCR采用7900HT熒光定量PCR儀。擴增參數:95 °C預變性5 min,95 °C變性10 s,退火30 s,退火溫度60 °C,循環40次后利用溶解曲線檢測產物特異性。從60 °C至97 °C緩慢增加溫度,每°C采集5次熒光,繪制溶解曲線。目的基因擴增產物的相對含量用2-ΔΔCt計算。
采用中科普瑞自建的miRNA靶基因搜索引擎對差異miRNA的靶基因進行檢索,所得差異miRNA靶基因的基因注釋(GO)和京都基因與基因組百科全書(KEGG)富集分析由北京霖源生物科技有限公司完成。
1.3 統計學方法
采用SPSS22.0軟件進行統計學分析。所有數據以均數±標準差( )表示。組間兩兩比較采用獨立樣本t檢驗,P<0.05為差異有統計學意義。
)表示。組間兩兩比較采用獨立樣本t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 熒光顯微鏡及病理切片
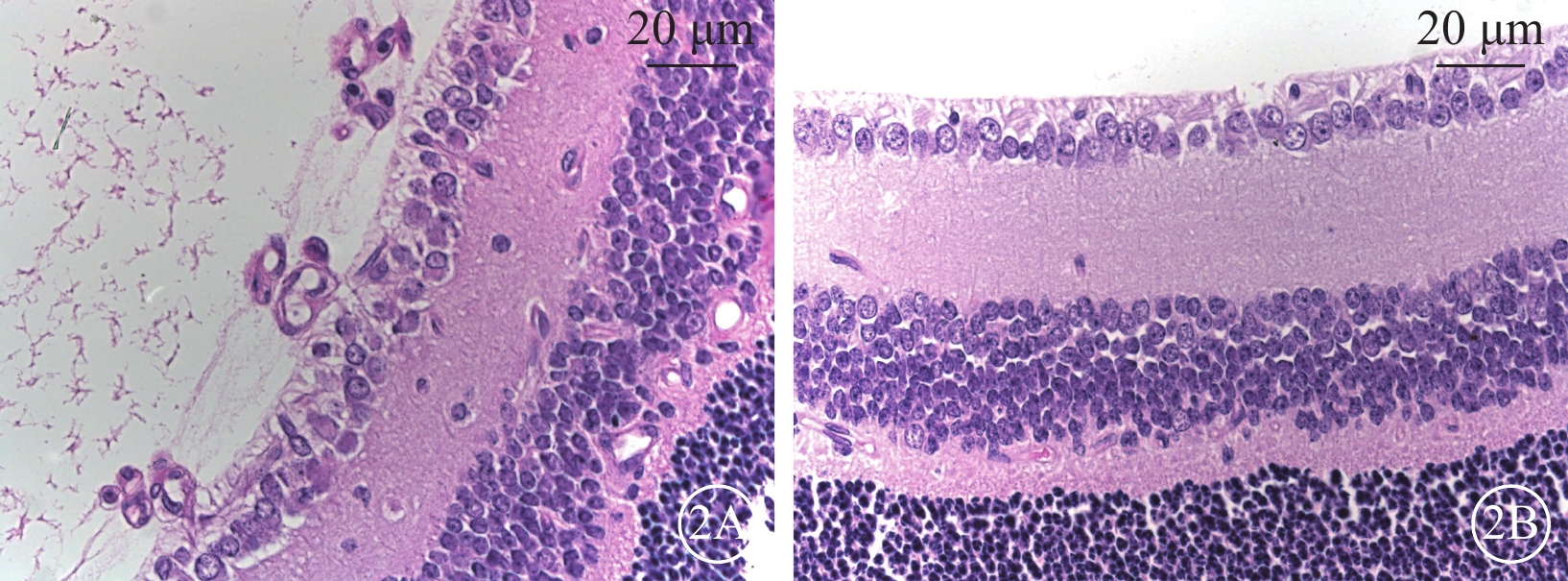
熒光顯微鏡觀察發現,對照組小鼠視網膜未見無灌注區及新生血管(圖1A,1B);OIR組小鼠視網膜可見大量無灌注區和新生血管(圖1C,1D)。光學顯微鏡觀察發現,對照組小鼠未見突破視網膜內界膜的血管內皮細胞核(圖2A);OIR組小鼠可見大量突破視網膜內界膜的血管內皮細胞核(圖2B)。兩組小鼠突破視網膜內界膜的血管內皮細胞核數量比較,差異有統計學意義(t=9.025,P<0.05)。
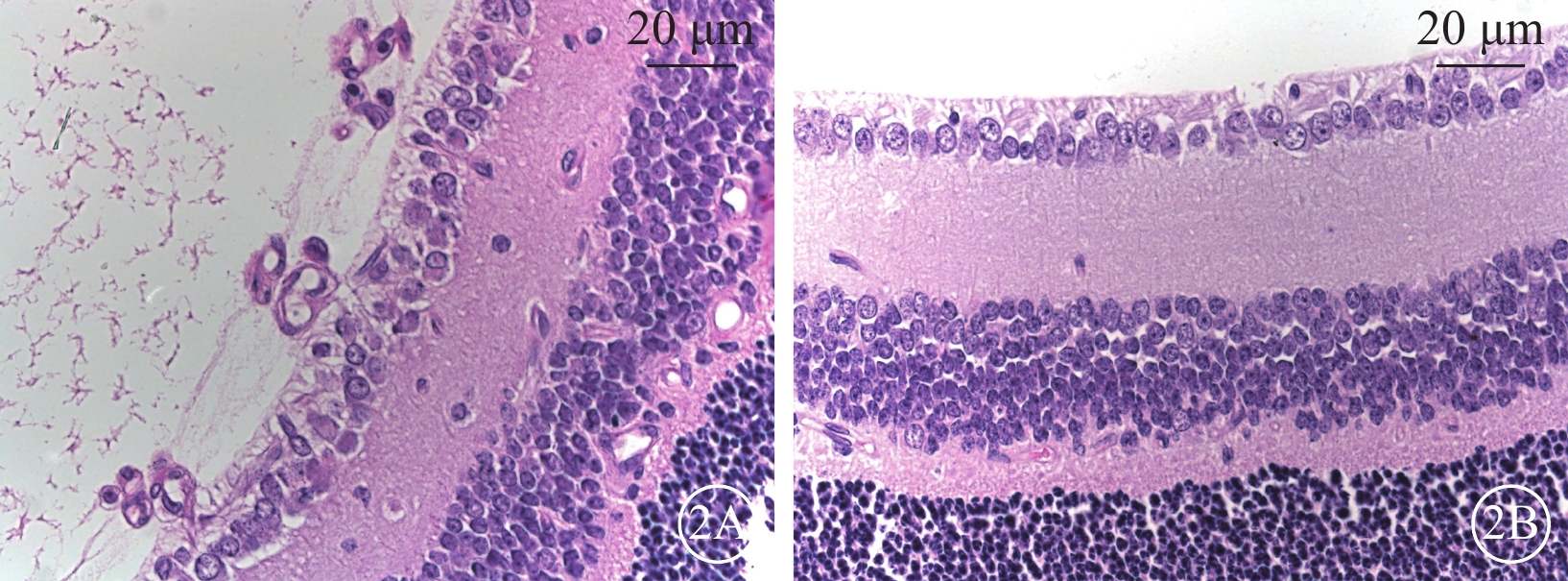 圖2
小鼠視網膜病理切片光學顯微鏡像。2A示對照組,未見突破視網膜內界膜的血管內皮細胞核;2B示OIR組,可見多個突破視網膜內界膜的血管內皮細胞核(黑箭) HE 標尺:20 μm
圖2
小鼠視網膜病理切片光學顯微鏡像。2A示對照組,未見突破視網膜內界膜的血管內皮細胞核;2B示OIR組,可見多個突破視網膜內界膜的血管內皮細胞核(黑箭) HE 標尺:20 μm
2.2 miRNA芯片分析結果及RT-PCR結果
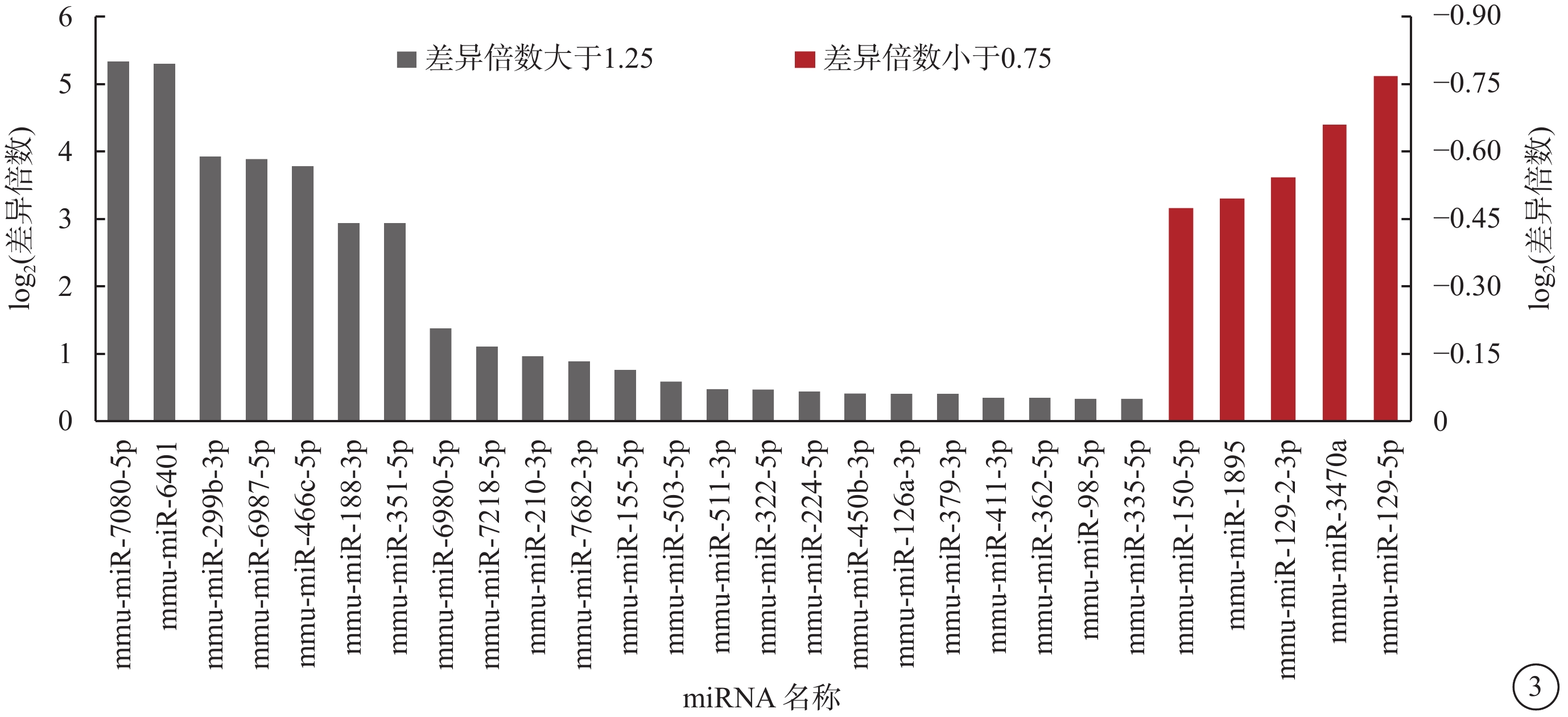
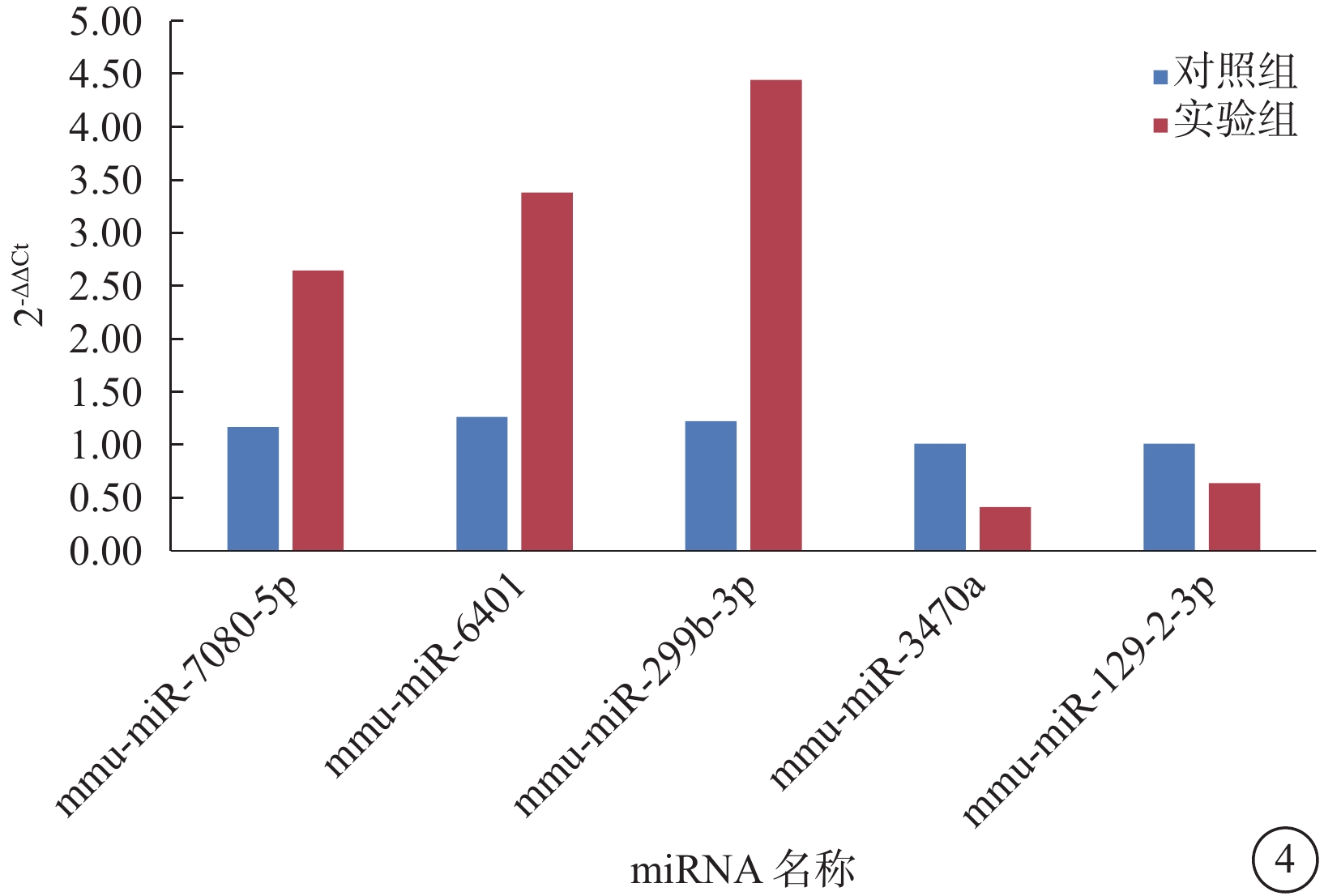
基因芯片分析共鑒定出1882個miRNA,與對照組比較,OIR組有54個miRNA發生了具有統計學差異的 表達(圖3)。其中,上調者47個,下調者7個;差異表達倍數大于1.25倍者23個,小于0.75倍者5個。差異表達倍數最高的5個miRNA分別為miR-7080-5p、miR-6401、miR-299b-3p、miR-3470a、miR-129-2-3p。RT-PCR驗證結果顯示,兩組表達趨勢與芯片分析結果一致。兩組差異表達最高的5個miRNA表達比較,差異均有統計學意義(P=0.047、0.036、0.005、0.013、0.047)(圖4)。
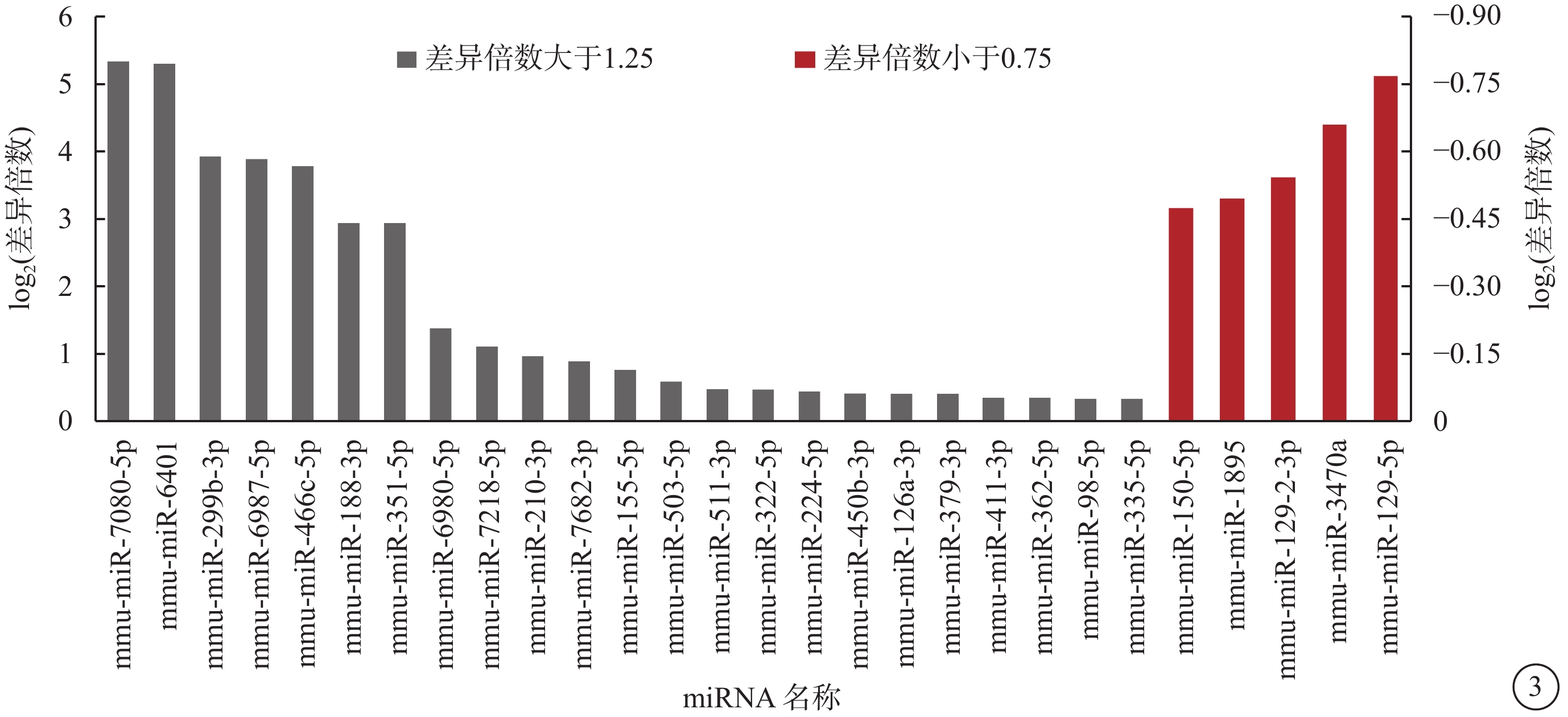 圖3
具有顯著差異表達的miRNA
圖3
具有顯著差異表達的miRNA
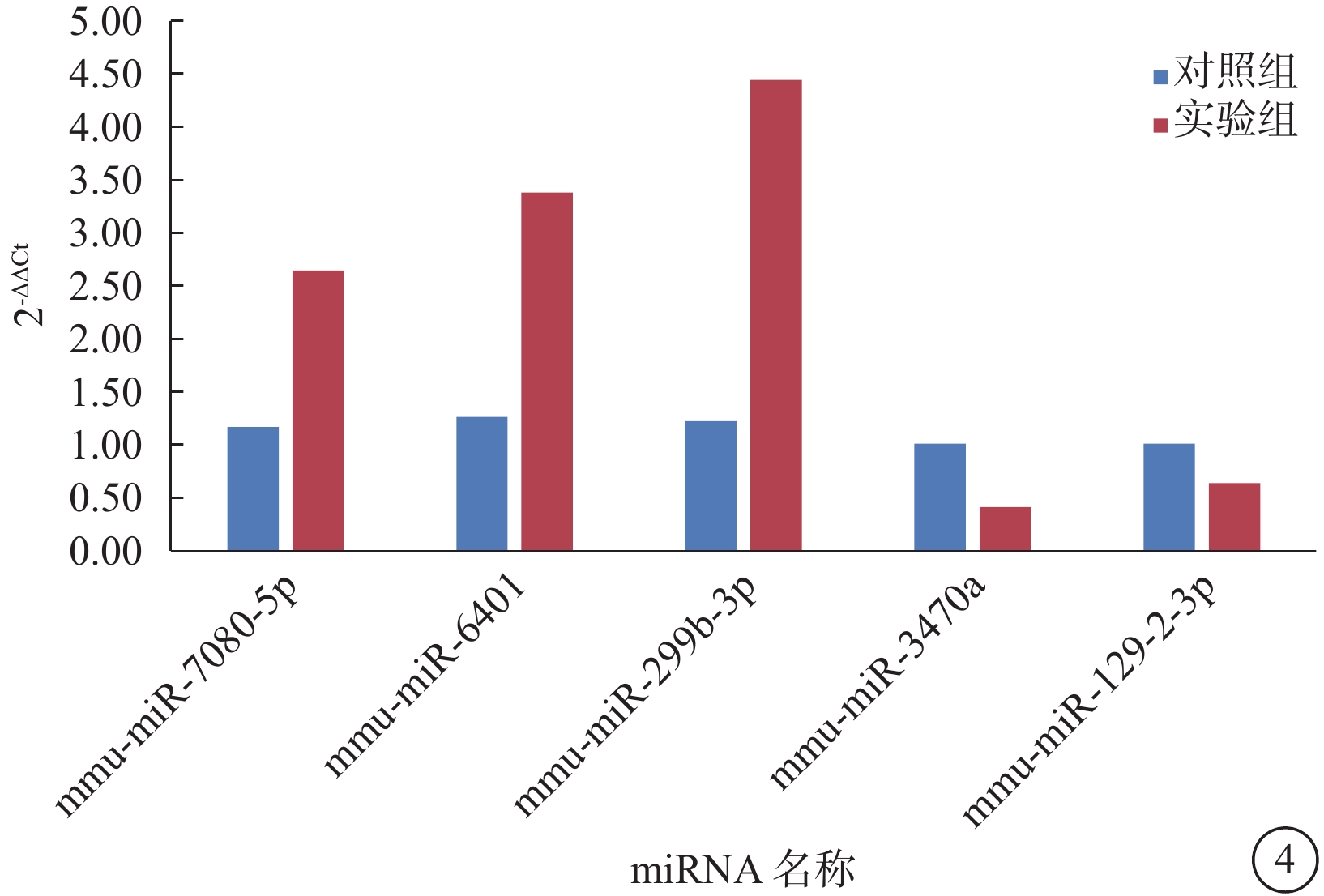 圖4
兩組小鼠視網膜差異表達倍數最高的5個miRNA表達比較
圖4
兩組小鼠視網膜差異表達倍數最高的5個miRNA表達比較
2.3 差異miRNA靶基因GO分析
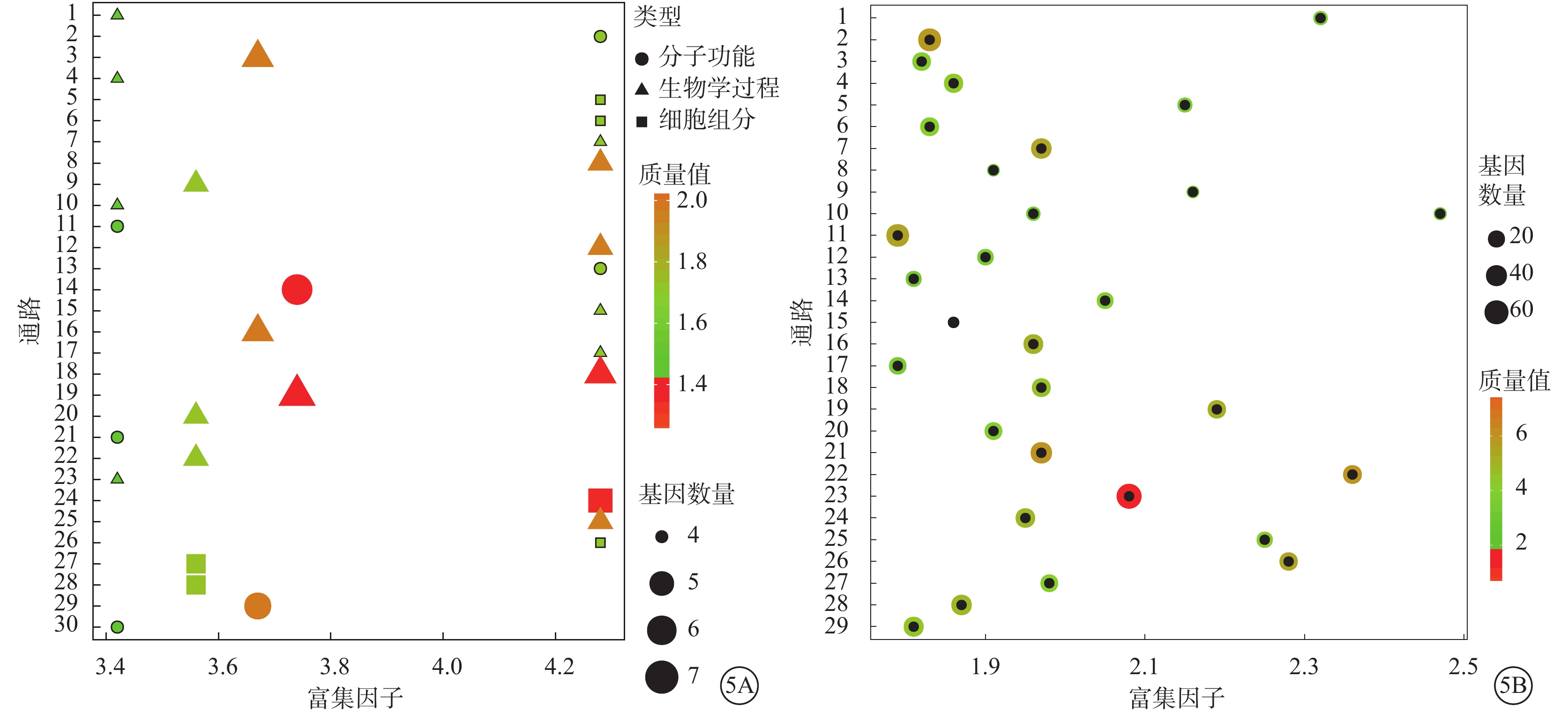
GO分析共得到1112個差異有統計學意義的條目(P<0.05)。其中,富集度較高的主要是細胞增生相關和細胞周期相關條目(圖5A)。
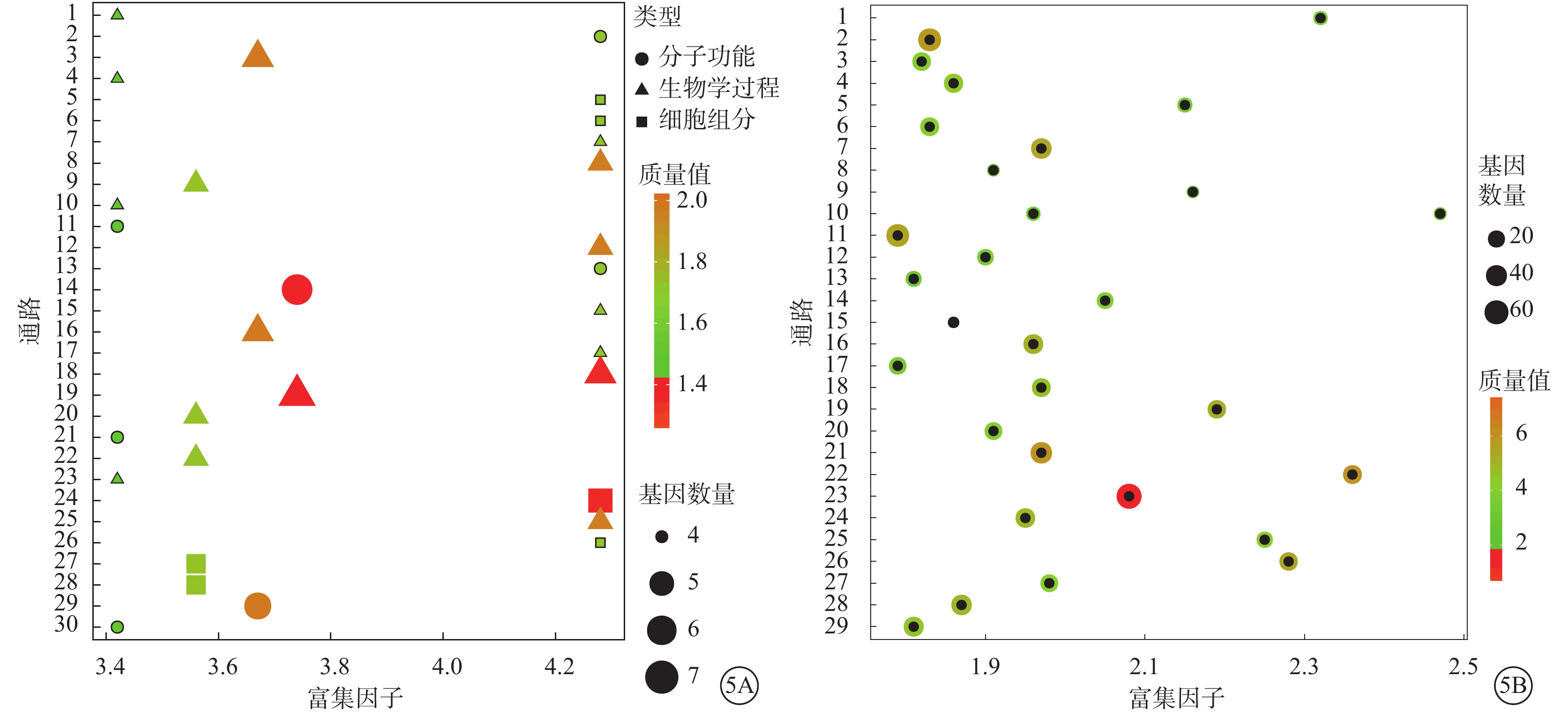 圖5
差異miRNA靶基因GO、KEGG分析圖。5A示超幾何檢驗后差異基因相關GO條目。橫坐標為富集程度排序前30項結果,縱坐標為具體GO條目名稱。圖中點的顏色表示GO顯著程度;點的形狀和顏色表示對應的GO條目分屬于GO數據庫三大分類中具體項;點的大小表征映射到GO條目內的基因數量。通路名稱:1. 脂肪酸延長作用,飽和脂肪酸;2. 脂肪酸延伸酶活性;3. 長期神經元突觸可塑性的正調控;4. 原隔發育;5. 突觸素2-SNAP-25-突觸素-1a-復合素Ⅰ復合物;6. 突觸素2-SNAP-25-突觸素-1a-復合素Ⅱ復合物;7. 舌咽神經形態發生;8. 舌咽神經發育;9. 傷口愈合中上皮細胞增生的正調控;10. 溶酶體腔酸化;11. 磷脂酰肌醇-4,5-雙磷酸3-激酶活性;12. 磷脂酰膽堿分解代謝過程;13. 甲基胞嘧啶雙加氧酶活性;14. 甘露糖-寡糖1,2-α-甘露糖苷酶活性;15. 鈣黏著蛋白介導的細胞黏附的正調控;16. 鈣離子外流;17. 腹脊髓涉及的平滑信號通路的負調控;18. 參與肺形態發生的上皮細胞增生的正調控;19. 參與肺形態發生的上皮細胞增生的調控;20. 參與肺形態發生的分支調節;21. α-N-乙酰神經氨酸α-2,8-唾液酸轉移酶活性;22. RNA聚合酶II啟動子轉錄正調控調節的細胞酮代謝過程;23. RNA聚合酶II啟動子轉錄的正調控對糖異生的正調控;24. MOZ/MORF組蛋白乙酰轉移酶復合物;25. JNKK活性的激活;26. Hrd1p泛素連接酶復合物;27. CRD介導的mRNA穩定復合物;28. CCR4-NOT核心復合體;29. ADP-核糖基化因子結合;30. 激活素激活受體活性。5B示靶基因KEGG通路富集結果氣泡圖。橫坐標為按照富集程度排序前30項結果,縱坐標為KEGG條目名稱。圖中點的顏色表示KEGG的顯著程度;點的大小表征映射到KEGG條目內的基因數量。通路名稱:1.晝夜節律;2. 軸突引導;3. 長時程增強;4. 粘附連接;5. 粘蛋白型O-聚糖的生物合成;6. 胰腺癌;7. 小細胞肺癌;8. 硒化合物代謝;9. 糖鞘脂生物合成;10. 糖胺聚糖的生物合成;11. 神經營養蛋白信號通路;12. 醛固酮調節的鈉重吸收;13. 鞘脂代謝;14. 其他類型的O-聚糖生物合成;15. 硫代謝;16. 磷脂酰肌醇信號系統;17. 磷酸肌醇代謝;18. 膠質瘤;19. 基底細胞癌;20. 肌萎縮性側索硬化癥;21. 黑色素生成;22. 非小細胞肺癌;23. Wnt信號通路;24. VEGF信號通路;25. SNARE在膜泡運輸中作用;26. mTOR信號通路;27. Hedgehog信號通路;28. FcγR介導的吞噬作用;29. ErbB信號通路。通路名稱:1.晝夜節律;2. 軸突引導;3. 長時程增強;4. 粘附連接;5. 粘蛋白型O-聚糖的生物合成;6. 胰腺癌;7. 小細胞肺癌;8. 硒化合物代謝;9. 糖鞘脂生物合成;10. 糖胺聚糖的生物合成;11. 神經營養蛋白信號通路;12. 醛固酮調節的鈉重吸收;13. 鞘脂代謝;14. 其他類型的O-聚糖生物合成;15. 硫代謝;16. 磷脂酰肌醇信號系統;17. 磷酸肌醇代謝;18. 膠質瘤;19. 基底細胞癌;20. 肌萎縮性側索硬化癥;21. 黑色素生成;22. 非小細胞肺癌;23. Wnt信號通路;24. VEGF信號通路;25. SNARE在膜泡運輸中作用;26. mTOR信號通路;27. Hedgehog信號通路;28. FcγR介導的吞噬作用;29. ErbB信號通路
圖5
差異miRNA靶基因GO、KEGG分析圖。5A示超幾何檢驗后差異基因相關GO條目。橫坐標為富集程度排序前30項結果,縱坐標為具體GO條目名稱。圖中點的顏色表示GO顯著程度;點的形狀和顏色表示對應的GO條目分屬于GO數據庫三大分類中具體項;點的大小表征映射到GO條目內的基因數量。通路名稱:1. 脂肪酸延長作用,飽和脂肪酸;2. 脂肪酸延伸酶活性;3. 長期神經元突觸可塑性的正調控;4. 原隔發育;5. 突觸素2-SNAP-25-突觸素-1a-復合素Ⅰ復合物;6. 突觸素2-SNAP-25-突觸素-1a-復合素Ⅱ復合物;7. 舌咽神經形態發生;8. 舌咽神經發育;9. 傷口愈合中上皮細胞增生的正調控;10. 溶酶體腔酸化;11. 磷脂酰肌醇-4,5-雙磷酸3-激酶活性;12. 磷脂酰膽堿分解代謝過程;13. 甲基胞嘧啶雙加氧酶活性;14. 甘露糖-寡糖1,2-α-甘露糖苷酶活性;15. 鈣黏著蛋白介導的細胞黏附的正調控;16. 鈣離子外流;17. 腹脊髓涉及的平滑信號通路的負調控;18. 參與肺形態發生的上皮細胞增生的正調控;19. 參與肺形態發生的上皮細胞增生的調控;20. 參與肺形態發生的分支調節;21. α-N-乙酰神經氨酸α-2,8-唾液酸轉移酶活性;22. RNA聚合酶II啟動子轉錄正調控調節的細胞酮代謝過程;23. RNA聚合酶II啟動子轉錄的正調控對糖異生的正調控;24. MOZ/MORF組蛋白乙酰轉移酶復合物;25. JNKK活性的激活;26. Hrd1p泛素連接酶復合物;27. CRD介導的mRNA穩定復合物;28. CCR4-NOT核心復合體;29. ADP-核糖基化因子結合;30. 激活素激活受體活性。5B示靶基因KEGG通路富集結果氣泡圖。橫坐標為按照富集程度排序前30項結果,縱坐標為KEGG條目名稱。圖中點的顏色表示KEGG的顯著程度;點的大小表征映射到KEGG條目內的基因數量。通路名稱:1.晝夜節律;2. 軸突引導;3. 長時程增強;4. 粘附連接;5. 粘蛋白型O-聚糖的生物合成;6. 胰腺癌;7. 小細胞肺癌;8. 硒化合物代謝;9. 糖鞘脂生物合成;10. 糖胺聚糖的生物合成;11. 神經營養蛋白信號通路;12. 醛固酮調節的鈉重吸收;13. 鞘脂代謝;14. 其他類型的O-聚糖生物合成;15. 硫代謝;16. 磷脂酰肌醇信號系統;17. 磷酸肌醇代謝;18. 膠質瘤;19. 基底細胞癌;20. 肌萎縮性側索硬化癥;21. 黑色素生成;22. 非小細胞肺癌;23. Wnt信號通路;24. VEGF信號通路;25. SNARE在膜泡運輸中作用;26. mTOR信號通路;27. Hedgehog信號通路;28. FcγR介導的吞噬作用;29. ErbB信號通路。通路名稱:1.晝夜節律;2. 軸突引導;3. 長時程增強;4. 粘附連接;5. 粘蛋白型O-聚糖的生物合成;6. 胰腺癌;7. 小細胞肺癌;8. 硒化合物代謝;9. 糖鞘脂生物合成;10. 糖胺聚糖的生物合成;11. 神經營養蛋白信號通路;12. 醛固酮調節的鈉重吸收;13. 鞘脂代謝;14. 其他類型的O-聚糖生物合成;15. 硫代謝;16. 磷脂酰肌醇信號系統;17. 磷酸肌醇代謝;18. 膠質瘤;19. 基底細胞癌;20. 肌萎縮性側索硬化癥;21. 黑色素生成;22. 非小細胞肺癌;23. Wnt信號通路;24. VEGF信號通路;25. SNARE在膜泡運輸中作用;26. mTOR信號通路;27. Hedgehog信號通路;28. FcγR介導的吞噬作用;29. ErbB信號通路
2.4 差異miRNA靶基因KEGG分析
KEGG分析共得到65個差異有統計學意義的條目(P<0.05)。其中,富集程度前30的通路均與血管生成或細胞增生相關(圖5B)。
3 討論
RNV是嚴重的致盲原因之一,常見于糖尿病視網膜病變、視網膜血管阻塞性疾病、視網膜靜脈周圍炎、早產兒視網膜病變等[8]。來源于Müller細胞和RPE細胞的VEGF是促進新生血管形成的主要生長因子[9-14]。VEGF的活化是血管生成過程中關鍵的限速步驟,VEGF可以刺激血管內皮細胞的有絲分裂和遷徙,增加血管的通透性,誘導毛細血管腔的形成 [13, 15]。近年抗VEGF藥物在臨床中廣泛應用并取得良好的效果[16]。但抗VEGF藥物治療作用在新生血管的終末節點,持續時間有限,并可能會影響到正常血管[17]。因此,希望從新的視角揭示RNV的發生機制,為防治RNV尋找新的靶點。近年來各種生物信息測序技術在生命科學研究領域得到廣泛應用,從而賦予生物醫學強大的數據產出能力[18-21]。
隨著對miRNA研究的不斷進展,已發現多種miRNA在眼部的表達以及在RNV性疾病中調節新生血管生成的作用。van Mil等[22]發現miR-214直接作用于Quaking蛋白,從而減少VEGF、血小板源性生長因子的表達,抑制RNV。有研究發現,miR-29可抑制MMP-2,并通過下調血管緊張素原等多種途徑起到抑制RNV的作用[23-24]。此外,部分miRNA雖未被證實在RNV中的作用,但與血管的生成密切相關。miR-150可通過抑制血管內皮細胞增生,進而抑制新生血管[25]。miR-191作為miRNA的一種,通過多種途徑抑制新生血管的生成[26]。miRNA-370可通過上調p21的表達,抑制血管內皮細胞的生長,進而抑制新生血管的生成[7]。此外,miR-155、miR-146a、miR-130a、miR-495等多種miRNA都可促進新生血管的表達[27-28]。本研究通過miRNA芯片技術對已知miRNA進行探測,發現OIR小鼠視網膜組織與正常組比較,表達顯著上調的miRNA包括miR-188-3p、miR-299b-3p、miR-351-5p、miR-6401、miR-6987-5p、miR-7080-5p和miR-466c-5p;表達顯著下調的miRNA包括miR-129-5p、miR-150-5p、miR-1895和miR-3470a。Liu等[29]同樣檢測OIR小鼠視網膜組織與正常小鼠視網膜組織中miRNA的差異化表達,發現23個miRNA具有顯著差異,在上調明顯的miRNA中,miR-155與本研究結果一致;miR-129-5p、miR-129-3p、miR-150在本研究中也有明顯下調。Shen等[30]研究發現77個差異明顯的miRNA表達,上調明顯的miR-98,下調明顯的miR-129-5p、miR-129-3p在本研究中也有明顯的差異化表達,并且趨勢一致。本研究上調的miRNA中,miR-188-3p可促進結直腸癌細胞的增生和遷移[31]。也有報道miR-188-3p可促進無精癥患者精子細胞的凋亡[32]。miR-351-5p可通過Sirt6途徑促進腸黏膜氧化應激反應及炎性反應,從而加重腸部缺血再灌注損傷[33]。miR-466c-5p在結節性硬化的細胞中表達較正常細胞減低,具體機制尚不明確[34]。本研究下調的miRNA中,miR-129-5p報道較多,在OIR小鼠視網膜的基因芯片檢測研究中miR-129-5p均明顯下調。研究表明miR-129-5p可通過TGFβ誘導因子同源盒2途徑抑制膠質瘤細胞的增生和遷移,并使細胞有絲分裂停留在G0/G1期[35]。miR-129-5p也可調控Hedgehog信號通路相關因子VEGF、血管緊張素2、p21的表達,抑制腫瘤血管的生成[36]。而Hedgehog信號通路在RNV的發生發展中也發揮著重要作用[37]。因此我們推測,miR-129-5p可通過調控多種信號通路及相關因子VEGF、血管緊張素2、p21等表達發揮抑制RNV的作用,是基因治療RNV的潛在靶點。有研究發現,甲狀腺癌中上調miR-150-5p可促進細胞增生,抑制細胞凋亡[38]。這些表達差異顯著的miRNA在血管生成中是否發揮作用,仍需進一步探索研究。
由于miRNA與mRNA之間作用的復雜性,同一miRNA的表達在不同疾病或生理過程中有所不同,而這些miRNA的具體作用亦尚無定論,但其中頻繁涉及到一些通路和分子,如Wnt通路、蛋白激酶(AKT)-細胞外信號調節激酶、表皮生長因子(EGF)受體(EGFR)等,這也提示我們關注這些關鍵節點。此次一共篩選到65條KEGG通路及1112個GO條目有顯著差異,在KEGG數據庫中搜索可發現,富集程度前30的通路均與血管生成或細胞增生相關,且各通路所涉及的基因具有較高的重復性,包括Wnt、EGF-EGFR、成纖維生長因子-FGFR、VEGF、磷脂酰肌醇激酶、AKT、聚醇酸酯等基因家族。而在GO分析中,富集度較高的主要是細胞增生相關細胞周期相關的條目,如細胞周期正向調控、細胞周期蛋白依賴性激酶活性上調、對細胞周期停滯的負向調控等。
本研究結果表明,與正常小鼠視網膜組織比較,差異化表達顯著的miRNA廣泛存在于OIR小鼠視網膜組織中,無論上調或下調表達的miRNA都可能在RNV生成中起到關鍵作用,并為今后miRNA在RNV性疾病中的診斷和治療提供幫助,同時,我們應認識到小鼠模型中miRNA的差異表達,與人相關眼病的實際情況有所不同,并且在眾多差異化表達的miRNA中對每種miRNA的篩選和驗證,資源成本高,得到有意義的miRNA難度較大,因此需要進一步探索本研究中部分miRNA在RNV生成中的有關具體機制。
視網膜新生血管(RNV)性疾病是導致各個年齡段視覺障礙的主要原因。異常增生的新生血管通過多種途徑以及多種因子的調節[1-2]。近年來,隨著對miRNA研究的不斷深入,多種miRNA在眼部的表達及其在RNV性疾病中調節新生血管生成的作用已被發現[3-4]。如miRNA-329和miRNA-191顯著抑制新生血管形成;miRNA370可通過上調p21的表達,抑制血管內皮細胞生長,進而抑制新生血管生成[5-7]。本研究擬通過miRNA芯片檢測分析挖掘氧誘導視網膜病變(OIR)模型小鼠視網膜組織中較正常小鼠視網膜組織表達具有顯著差異的miRNA并輔以后續的驗證,為今后尋找抑制RNV的新靶點提供理論依據。現將結果報道如下。
1 材料和方法
1.1 主要實驗材料
7日齡C57BL/6J小鼠80只,清潔級,平均體重(3.53±0.37)g,雌雄不限,由斯貝福(北京)生物技術有限公司提供。飼養環境及實驗操作均符合國家科學技術委員會《實驗動物管理條例》的規定,并獲得天津醫科大學眼科醫院動物倫理委員會許可(倫理編號:TJYY20190103002)。80%氧氣和20%氮氣混合氣體(天津市華氧液化空氣制品有限公司),解剖顯微鏡(美國Zeiss公司),病理切片機RM2165(德國Leica公司),包埋機EG1160(德國Leica公司),熒光顯微鏡(日本Nikon公司),異硫氰酸熒光素葡聚糖(美國Sigma公司)。
1.2 實驗方法
采用隨機數字表法將小鼠分為對照組、OIR組,每組40只。OIR組小鼠參照文獻[3]的方法構建OIR模型,將小鼠置于含氧氣濃度為(75±2)%的飼養箱中,溫度維持在(23±2)℃,氧氣分析儀監測并調控飼養箱內的氧氣含量。對照組小鼠不做任何處理。
小鼠17日齡時,每組取5只小鼠腹腔注射過量10%水合氯醛處死。摘取眼球,4%多聚甲醛室溫固定1 h,之后將眼球放入PBS(pH7.4)中4 ℃保存。手術顯微鏡下剝離完整的視網膜,并于4 ℃過夜固定。參照文獻[4]的方法對視網膜血管進行染色,染色后的標本以節細胞層向上平鋪于載玻片上,含DAPI的抗熒光衰退封片劑封片。熒光顯微鏡下采用與文獻[4]相同的光學參數拍照。
小鼠17日齡時,每組取5只小鼠腹腔注射過量10%水合氯醛處死。摘除眼球,標記方向后立即置于4%多聚甲醛中4 °C過夜,次日,常規脫水、透明、浸蠟,石蠟包埋,矢狀面平行視神經進行連續切片,片厚5 μm,每片相隔30 μm,去掉有視神經的切面。每只眼球選取10個切片,常規脫蠟后行HE染色。雙盲法統計每張切片中突破視網膜內界膜的血管內皮細胞核數目,同時排除玻璃體腔與視網膜內界膜無聯系的血管內皮細胞核。
小鼠17日齡時,每組取30只小鼠腹腔注射過量10%水合氯醛處死。摘除眼球,取視網膜組織立即放入液氮中,并放入-80 ℃冰箱中。其中20只小鼠眼球視網膜標本由北京霖源生物科技有限公司行基因芯片分析;另外10只小鼠眼球在取得miRNA基因芯片結果后采用逆轉錄(RT)-PCR驗證芯片檢測差異倍數最高的5個miRNA。將眼球組織放入勻漿器混勻,加入勻漿添加劑冰上勻漿10 min。1 ml裂解液中加入200 μl氯仿,渦旋30 s,以離心半徑15 cm、轉速12 000 r/min離心5 min,取上清液置于新管中,記錄體積;加入1.25倍體積的100%乙醇,渦旋混勻,反復過純化柱,以離心半徑15 cm、轉速12 000 r/min離心15 s;將離心柱放置到新的收集管中,柱中心加入100 μl 95 °C預熱的洗脫液,室溫條件下,以離心半徑15 cm、轉速12 000 r/min離心30 s,收集管中液體即為提取的Total RNA,Nanodrop 2000分光光度計測定miRNA的含量和純度,-80 ℃保存待用。利用miScript Ⅱ Reverse Transcription Kit(德國Qiagen公司)逆轉miRNA并行PCR反應。按說明書中的反應體系和操作步驟進行逆轉。利用Green PCR Kit試劑盒(德國Qiagen公司)在LightCycler 480 Ⅱ型熒光定量PCR儀(瑞士Roche公司)上進行反應。參數:37 ℃孵育60 min,85 ℃變性5 min。合成的cDNA于-80 ℃保存備用。cDNA經5倍稀釋后與正反向引物一起進行RT-PCR反應。引物設計來源于天津深藍易源生物科技有限公司,由北京擎科新業生物技術有限公司合成。miR-7080-5p:GTAGGAGCTGGAGGTGGGTT;miR-6401:TTACACTCCAGTGGTGTCGG;miR-299b-3p:TATGTGGGACGGTAAACCAA;miR-3470a:TCACTTTGTAGACCAGGCTG;miR-129-2-3p:AAGCCCTTACCCCAAAAAGCA,序列均為5'-3'。RT-PCR采用7900HT熒光定量PCR儀。擴增參數:95 °C預變性5 min,95 °C變性10 s,退火30 s,退火溫度60 °C,循環40次后利用溶解曲線檢測產物特異性。從60 °C至97 °C緩慢增加溫度,每°C采集5次熒光,繪制溶解曲線。目的基因擴增產物的相對含量用2-ΔΔCt計算。
采用中科普瑞自建的miRNA靶基因搜索引擎對差異miRNA的靶基因進行檢索,所得差異miRNA靶基因的基因注釋(GO)和京都基因與基因組百科全書(KEGG)富集分析由北京霖源生物科技有限公司完成。
1.3 統計學方法
采用SPSS22.0軟件進行統計學分析。所有數據以均數±標準差( )表示。組間兩兩比較采用獨立樣本t檢驗,P<0.05為差異有統計學意義。
)表示。組間兩兩比較采用獨立樣本t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 熒光顯微鏡及病理切片
熒光顯微鏡觀察發現,對照組小鼠視網膜未見無灌注區及新生血管(圖1A,1B);OIR組小鼠視網膜可見大量無灌注區和新生血管(圖1C,1D)。光學顯微鏡觀察發現,對照組小鼠未見突破視網膜內界膜的血管內皮細胞核(圖2A);OIR組小鼠可見大量突破視網膜內界膜的血管內皮細胞核(圖2B)。兩組小鼠突破視網膜內界膜的血管內皮細胞核數量比較,差異有統計學意義(t=9.025,P<0.05)。
 圖2
小鼠視網膜病理切片光學顯微鏡像。2A示對照組,未見突破視網膜內界膜的血管內皮細胞核;2B示OIR組,可見多個突破視網膜內界膜的血管內皮細胞核(黑箭) HE 標尺:20 μm
圖2
小鼠視網膜病理切片光學顯微鏡像。2A示對照組,未見突破視網膜內界膜的血管內皮細胞核;2B示OIR組,可見多個突破視網膜內界膜的血管內皮細胞核(黑箭) HE 標尺:20 μm
2.2 miRNA芯片分析結果及RT-PCR結果
基因芯片分析共鑒定出1882個miRNA,與對照組比較,OIR組有54個miRNA發生了具有統計學差異的 表達(圖3)。其中,上調者47個,下調者7個;差異表達倍數大于1.25倍者23個,小于0.75倍者5個。差異表達倍數最高的5個miRNA分別為miR-7080-5p、miR-6401、miR-299b-3p、miR-3470a、miR-129-2-3p。RT-PCR驗證結果顯示,兩組表達趨勢與芯片分析結果一致。兩組差異表達最高的5個miRNA表達比較,差異均有統計學意義(P=0.047、0.036、0.005、0.013、0.047)(圖4)。
 圖3
具有顯著差異表達的miRNA
圖3
具有顯著差異表達的miRNA
 圖4
兩組小鼠視網膜差異表達倍數最高的5個miRNA表達比較
圖4
兩組小鼠視網膜差異表達倍數最高的5個miRNA表達比較
2.3 差異miRNA靶基因GO分析
GO分析共得到1112個差異有統計學意義的條目(P<0.05)。其中,富集度較高的主要是細胞增生相關和細胞周期相關條目(圖5A)。
 圖5
差異miRNA靶基因GO、KEGG分析圖。5A示超幾何檢驗后差異基因相關GO條目。橫坐標為富集程度排序前30項結果,縱坐標為具體GO條目名稱。圖中點的顏色表示GO顯著程度;點的形狀和顏色表示對應的GO條目分屬于GO數據庫三大分類中具體項;點的大小表征映射到GO條目內的基因數量。通路名稱:1. 脂肪酸延長作用,飽和脂肪酸;2. 脂肪酸延伸酶活性;3. 長期神經元突觸可塑性的正調控;4. 原隔發育;5. 突觸素2-SNAP-25-突觸素-1a-復合素Ⅰ復合物;6. 突觸素2-SNAP-25-突觸素-1a-復合素Ⅱ復合物;7. 舌咽神經形態發生;8. 舌咽神經發育;9. 傷口愈合中上皮細胞增生的正調控;10. 溶酶體腔酸化;11. 磷脂酰肌醇-4,5-雙磷酸3-激酶活性;12. 磷脂酰膽堿分解代謝過程;13. 甲基胞嘧啶雙加氧酶活性;14. 甘露糖-寡糖1,2-α-甘露糖苷酶活性;15. 鈣黏著蛋白介導的細胞黏附的正調控;16. 鈣離子外流;17. 腹脊髓涉及的平滑信號通路的負調控;18. 參與肺形態發生的上皮細胞增生的正調控;19. 參與肺形態發生的上皮細胞增生的調控;20. 參與肺形態發生的分支調節;21. α-N-乙酰神經氨酸α-2,8-唾液酸轉移酶活性;22. RNA聚合酶II啟動子轉錄正調控調節的細胞酮代謝過程;23. RNA聚合酶II啟動子轉錄的正調控對糖異生的正調控;24. MOZ/MORF組蛋白乙酰轉移酶復合物;25. JNKK活性的激活;26. Hrd1p泛素連接酶復合物;27. CRD介導的mRNA穩定復合物;28. CCR4-NOT核心復合體;29. ADP-核糖基化因子結合;30. 激活素激活受體活性。5B示靶基因KEGG通路富集結果氣泡圖。橫坐標為按照富集程度排序前30項結果,縱坐標為KEGG條目名稱。圖中點的顏色表示KEGG的顯著程度;點的大小表征映射到KEGG條目內的基因數量。通路名稱:1.晝夜節律;2. 軸突引導;3. 長時程增強;4. 粘附連接;5. 粘蛋白型O-聚糖的生物合成;6. 胰腺癌;7. 小細胞肺癌;8. 硒化合物代謝;9. 糖鞘脂生物合成;10. 糖胺聚糖的生物合成;11. 神經營養蛋白信號通路;12. 醛固酮調節的鈉重吸收;13. 鞘脂代謝;14. 其他類型的O-聚糖生物合成;15. 硫代謝;16. 磷脂酰肌醇信號系統;17. 磷酸肌醇代謝;18. 膠質瘤;19. 基底細胞癌;20. 肌萎縮性側索硬化癥;21. 黑色素生成;22. 非小細胞肺癌;23. Wnt信號通路;24. VEGF信號通路;25. SNARE在膜泡運輸中作用;26. mTOR信號通路;27. Hedgehog信號通路;28. FcγR介導的吞噬作用;29. ErbB信號通路。通路名稱:1.晝夜節律;2. 軸突引導;3. 長時程增強;4. 粘附連接;5. 粘蛋白型O-聚糖的生物合成;6. 胰腺癌;7. 小細胞肺癌;8. 硒化合物代謝;9. 糖鞘脂生物合成;10. 糖胺聚糖的生物合成;11. 神經營養蛋白信號通路;12. 醛固酮調節的鈉重吸收;13. 鞘脂代謝;14. 其他類型的O-聚糖生物合成;15. 硫代謝;16. 磷脂酰肌醇信號系統;17. 磷酸肌醇代謝;18. 膠質瘤;19. 基底細胞癌;20. 肌萎縮性側索硬化癥;21. 黑色素生成;22. 非小細胞肺癌;23. Wnt信號通路;24. VEGF信號通路;25. SNARE在膜泡運輸中作用;26. mTOR信號通路;27. Hedgehog信號通路;28. FcγR介導的吞噬作用;29. ErbB信號通路
圖5
差異miRNA靶基因GO、KEGG分析圖。5A示超幾何檢驗后差異基因相關GO條目。橫坐標為富集程度排序前30項結果,縱坐標為具體GO條目名稱。圖中點的顏色表示GO顯著程度;點的形狀和顏色表示對應的GO條目分屬于GO數據庫三大分類中具體項;點的大小表征映射到GO條目內的基因數量。通路名稱:1. 脂肪酸延長作用,飽和脂肪酸;2. 脂肪酸延伸酶活性;3. 長期神經元突觸可塑性的正調控;4. 原隔發育;5. 突觸素2-SNAP-25-突觸素-1a-復合素Ⅰ復合物;6. 突觸素2-SNAP-25-突觸素-1a-復合素Ⅱ復合物;7. 舌咽神經形態發生;8. 舌咽神經發育;9. 傷口愈合中上皮細胞增生的正調控;10. 溶酶體腔酸化;11. 磷脂酰肌醇-4,5-雙磷酸3-激酶活性;12. 磷脂酰膽堿分解代謝過程;13. 甲基胞嘧啶雙加氧酶活性;14. 甘露糖-寡糖1,2-α-甘露糖苷酶活性;15. 鈣黏著蛋白介導的細胞黏附的正調控;16. 鈣離子外流;17. 腹脊髓涉及的平滑信號通路的負調控;18. 參與肺形態發生的上皮細胞增生的正調控;19. 參與肺形態發生的上皮細胞增生的調控;20. 參與肺形態發生的分支調節;21. α-N-乙酰神經氨酸α-2,8-唾液酸轉移酶活性;22. RNA聚合酶II啟動子轉錄正調控調節的細胞酮代謝過程;23. RNA聚合酶II啟動子轉錄的正調控對糖異生的正調控;24. MOZ/MORF組蛋白乙酰轉移酶復合物;25. JNKK活性的激活;26. Hrd1p泛素連接酶復合物;27. CRD介導的mRNA穩定復合物;28. CCR4-NOT核心復合體;29. ADP-核糖基化因子結合;30. 激活素激活受體活性。5B示靶基因KEGG通路富集結果氣泡圖。橫坐標為按照富集程度排序前30項結果,縱坐標為KEGG條目名稱。圖中點的顏色表示KEGG的顯著程度;點的大小表征映射到KEGG條目內的基因數量。通路名稱:1.晝夜節律;2. 軸突引導;3. 長時程增強;4. 粘附連接;5. 粘蛋白型O-聚糖的生物合成;6. 胰腺癌;7. 小細胞肺癌;8. 硒化合物代謝;9. 糖鞘脂生物合成;10. 糖胺聚糖的生物合成;11. 神經營養蛋白信號通路;12. 醛固酮調節的鈉重吸收;13. 鞘脂代謝;14. 其他類型的O-聚糖生物合成;15. 硫代謝;16. 磷脂酰肌醇信號系統;17. 磷酸肌醇代謝;18. 膠質瘤;19. 基底細胞癌;20. 肌萎縮性側索硬化癥;21. 黑色素生成;22. 非小細胞肺癌;23. Wnt信號通路;24. VEGF信號通路;25. SNARE在膜泡運輸中作用;26. mTOR信號通路;27. Hedgehog信號通路;28. FcγR介導的吞噬作用;29. ErbB信號通路。通路名稱:1.晝夜節律;2. 軸突引導;3. 長時程增強;4. 粘附連接;5. 粘蛋白型O-聚糖的生物合成;6. 胰腺癌;7. 小細胞肺癌;8. 硒化合物代謝;9. 糖鞘脂生物合成;10. 糖胺聚糖的生物合成;11. 神經營養蛋白信號通路;12. 醛固酮調節的鈉重吸收;13. 鞘脂代謝;14. 其他類型的O-聚糖生物合成;15. 硫代謝;16. 磷脂酰肌醇信號系統;17. 磷酸肌醇代謝;18. 膠質瘤;19. 基底細胞癌;20. 肌萎縮性側索硬化癥;21. 黑色素生成;22. 非小細胞肺癌;23. Wnt信號通路;24. VEGF信號通路;25. SNARE在膜泡運輸中作用;26. mTOR信號通路;27. Hedgehog信號通路;28. FcγR介導的吞噬作用;29. ErbB信號通路
2.4 差異miRNA靶基因KEGG分析
KEGG分析共得到65個差異有統計學意義的條目(P<0.05)。其中,富集程度前30的通路均與血管生成或細胞增生相關(圖5B)。
3 討論
RNV是嚴重的致盲原因之一,常見于糖尿病視網膜病變、視網膜血管阻塞性疾病、視網膜靜脈周圍炎、早產兒視網膜病變等[8]。來源于Müller細胞和RPE細胞的VEGF是促進新生血管形成的主要生長因子[9-14]。VEGF的活化是血管生成過程中關鍵的限速步驟,VEGF可以刺激血管內皮細胞的有絲分裂和遷徙,增加血管的通透性,誘導毛細血管腔的形成 [13, 15]。近年抗VEGF藥物在臨床中廣泛應用并取得良好的效果[16]。但抗VEGF藥物治療作用在新生血管的終末節點,持續時間有限,并可能會影響到正常血管[17]。因此,希望從新的視角揭示RNV的發生機制,為防治RNV尋找新的靶點。近年來各種生物信息測序技術在生命科學研究領域得到廣泛應用,從而賦予生物醫學強大的數據產出能力[18-21]。
隨著對miRNA研究的不斷進展,已發現多種miRNA在眼部的表達以及在RNV性疾病中調節新生血管生成的作用。van Mil等[22]發現miR-214直接作用于Quaking蛋白,從而減少VEGF、血小板源性生長因子的表達,抑制RNV。有研究發現,miR-29可抑制MMP-2,并通過下調血管緊張素原等多種途徑起到抑制RNV的作用[23-24]。此外,部分miRNA雖未被證實在RNV中的作用,但與血管的生成密切相關。miR-150可通過抑制血管內皮細胞增生,進而抑制新生血管[25]。miR-191作為miRNA的一種,通過多種途徑抑制新生血管的生成[26]。miRNA-370可通過上調p21的表達,抑制血管內皮細胞的生長,進而抑制新生血管的生成[7]。此外,miR-155、miR-146a、miR-130a、miR-495等多種miRNA都可促進新生血管的表達[27-28]。本研究通過miRNA芯片技術對已知miRNA進行探測,發現OIR小鼠視網膜組織與正常組比較,表達顯著上調的miRNA包括miR-188-3p、miR-299b-3p、miR-351-5p、miR-6401、miR-6987-5p、miR-7080-5p和miR-466c-5p;表達顯著下調的miRNA包括miR-129-5p、miR-150-5p、miR-1895和miR-3470a。Liu等[29]同樣檢測OIR小鼠視網膜組織與正常小鼠視網膜組織中miRNA的差異化表達,發現23個miRNA具有顯著差異,在上調明顯的miRNA中,miR-155與本研究結果一致;miR-129-5p、miR-129-3p、miR-150在本研究中也有明顯下調。Shen等[30]研究發現77個差異明顯的miRNA表達,上調明顯的miR-98,下調明顯的miR-129-5p、miR-129-3p在本研究中也有明顯的差異化表達,并且趨勢一致。本研究上調的miRNA中,miR-188-3p可促進結直腸癌細胞的增生和遷移[31]。也有報道miR-188-3p可促進無精癥患者精子細胞的凋亡[32]。miR-351-5p可通過Sirt6途徑促進腸黏膜氧化應激反應及炎性反應,從而加重腸部缺血再灌注損傷[33]。miR-466c-5p在結節性硬化的細胞中表達較正常細胞減低,具體機制尚不明確[34]。本研究下調的miRNA中,miR-129-5p報道較多,在OIR小鼠視網膜的基因芯片檢測研究中miR-129-5p均明顯下調。研究表明miR-129-5p可通過TGFβ誘導因子同源盒2途徑抑制膠質瘤細胞的增生和遷移,并使細胞有絲分裂停留在G0/G1期[35]。miR-129-5p也可調控Hedgehog信號通路相關因子VEGF、血管緊張素2、p21的表達,抑制腫瘤血管的生成[36]。而Hedgehog信號通路在RNV的發生發展中也發揮著重要作用[37]。因此我們推測,miR-129-5p可通過調控多種信號通路及相關因子VEGF、血管緊張素2、p21等表達發揮抑制RNV的作用,是基因治療RNV的潛在靶點。有研究發現,甲狀腺癌中上調miR-150-5p可促進細胞增生,抑制細胞凋亡[38]。這些表達差異顯著的miRNA在血管生成中是否發揮作用,仍需進一步探索研究。
由于miRNA與mRNA之間作用的復雜性,同一miRNA的表達在不同疾病或生理過程中有所不同,而這些miRNA的具體作用亦尚無定論,但其中頻繁涉及到一些通路和分子,如Wnt通路、蛋白激酶(AKT)-細胞外信號調節激酶、表皮生長因子(EGF)受體(EGFR)等,這也提示我們關注這些關鍵節點。此次一共篩選到65條KEGG通路及1112個GO條目有顯著差異,在KEGG數據庫中搜索可發現,富集程度前30的通路均與血管生成或細胞增生相關,且各通路所涉及的基因具有較高的重復性,包括Wnt、EGF-EGFR、成纖維生長因子-FGFR、VEGF、磷脂酰肌醇激酶、AKT、聚醇酸酯等基因家族。而在GO分析中,富集度較高的主要是細胞增生相關細胞周期相關的條目,如細胞周期正向調控、細胞周期蛋白依賴性激酶活性上調、對細胞周期停滯的負向調控等。
本研究結果表明,與正常小鼠視網膜組織比較,差異化表達顯著的miRNA廣泛存在于OIR小鼠視網膜組織中,無論上調或下調表達的miRNA都可能在RNV生成中起到關鍵作用,并為今后miRNA在RNV性疾病中的診斷和治療提供幫助,同時,我們應認識到小鼠模型中miRNA的差異表達,與人相關眼病的實際情況有所不同,并且在眾多差異化表達的miRNA中對每種miRNA的篩選和驗證,資源成本高,得到有意義的miRNA難度較大,因此需要進一步探索本研究中部分miRNA在RNV生成中的有關具體機制。